Химическая термодинамика.
Концепции современного естествознания

Что касается третьего начала термодинамики, согласно которому при абсолютной температуре Т, равной нулю, и энтропия равна нулю, то и оно используется в химической термодинамике. В частности, изучается нетривиальная ситуация, связанная с тем, что при низких температурах знак ДG определяется исключительно знаком АН. Это обстоятельство имеет существенное значение для криогенной химии. Где Н= U… Читать ещё >
Химическая термодинамика. Концепции современного естествознания (реферат, курсовая, диплом, контрольная)
В параграфе 2.20 рассматривалась термодинамика. Там же отмечалась закономерная взаимозависимость параметров энергии, температуры и энтропии. В химии термодинамика приобретает черты, характерные именно для химических процессов. В этой связи вводится ряд понятий, которые будут рассмотрены ниже. Химическая термодинамика — это наука о зависимости направления химических реакций и пределов их превращений в зависимости от условий, в которых находятся вещества. Замечательная особенность химической термодинамики состоит в том, что целый ряд актуальных выводов можно получить, не используя представления о строении вещества и механизмах происходящих внутри него процессов. Это означает, что ее выводы имеют довольно общий характер. Было бы неверно сводить всю химию к таким выводам, но в их актуальности не приходится сомневаться. В науке часто стремятся получить выводы при минимуме исходных данных. Такого рода ситуация весьма характерна для химической термодинамики, которая наряду с учением о строении вещества и химической кинетики является частью физической химии.
Чтобы выразить специфику химической термодинамики, для начала обратимся к первому началу термодинамики, согласно которому изменение количества теплоты (AQ) связано с изменением внутренней энергии (ДU) соотношением.

где W — совершаемая работа. Большинство химических реакций проходит в изобарных условиях, т. е. давление является неизменным. Обычно оно равно 1 атмосфере. С учетом этих обстоятельств уравнение (5.5) можно записать следующим образом:

где pAV — работа, произведенная в связи с изменением объема реагентов, a We — немеханическая работа, производимая, например, электромагнитными силами в гальванических элементах. Для большинства изобарных процессов We = 0. С учетом этого обстоятельства перепишем уравнение (5.6) следующим образом:
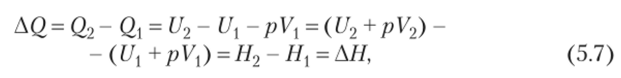
где Н= U + pVназывается энтальпией. Ее химический смысл состоит в том, что она характеризует энергетическое состояние химической реакции в изобарных условиях. Если химическая реакция является экзотермической, т. е. сопровождается выделением тепловой энергии, то Н2 > следовательно, АН > 0. В случае эндотермической ситуации АП < 0.
Согласно закону русского химика Г. И. Гесса, открытого им в далеком 1840 г., энтальпия реакции, имеющей место в изобарно-изотермических или изохорно-изотермических условиях, зависит только от природы и состояния исходных и конечных веществ, но не от пути ее протекания. Этот закон иллюстрируется рис. 5.7.
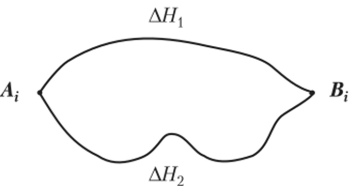
Рис. 5.7. Закон Гесса (AHt = АН2).
Энтальпия — величина аддитивная, т. е. для сложной системы она равна сумме энтальпий ее независимых частей. Единицей измерения энтальпии является кДж/моль. Стандартная энтальпия жидкой воды составляет 286 Дж/моль. Это означает, что при стандартных условиях (Т = 25 °C, р = = 1 атм) на образование 18 г воды из составляющих ее вещество атомов водорода и кислорода требуется 286 кДж энергии. Закон Гесса демонстрирует применимость закона сохранения энергии, выражаемого первым началом термодинамики, к энергетике химических реакций.
Выше мы извлекли некоторые химические выводы из первого начала термодинамики. Теперь нам предстоит сделать то же самое со вторым началом термодинамики, согласно которому в изолированных макроскопических системах, т. е. при отсутствии обмена энергией и веществом с окружающей средой, энтропия S либо возрастает, либо остается без изменения. Одного этого положения недостаточно для определения направленности хода химической реакции. Необходимо учитывать также изменение энергии. Но как это сделать? Суть дела впервые выяснил американский химик Дж. У. Гиббс.
Он ввел для характеристики химических реакций в изобарно-изотермических условиях особую функцию:

где G — энергия Гиббса (названа в честь ее изобретателя). С учетом постоянства температуры перепишем уравнение (5.8) в следующем виде:

Из этого выражения следует, что часть количества теплоты расходуется на увеличение энтропии AS. Эта часть энергии теряется, она не определяет ход реакции. Другое дело AG, именно эта характеристика определяет ход химической реакции. Если AG = G2 — G{ < 0, то реакция возможна. При AG > 0 она невозможна. Равенство AG = 0 характеризует химическое равновесие. В соответствии с уравнением (5.9) термодинамическая разрешимость или же неразрешимость химической реакции определяется вкладом энтальпийной и энтропийной составляющих (табл. 5.9).
Таблица 5.9
Условия термодинамической возможности реакций.
A HAS | AG. | Термодинамическая возможность реакции. |
АН < 0, Д51 >0. | AG < 0. | Возможна. |
АН > 0, AS < 0. | AG > 0. | Невозможна. |
АН < 0, Д5 < 0. | AG < 0. | Возможна (при низких температурах). |
AG > 0. | Невозможна. | |
АН > 0, AS >0. | AG < 0. | Возможна (при высоких температурах). |
AG > 0. | Невозможна. |
Что касается третьего начала термодинамики, согласно которому при абсолютной температуре Т, равной нулю, и энтропия равна нулю, то и оно используется в химической термодинамике. В частности, изучается нетривиальная ситуация, связанная с тем, что при низких температурах знак ДG определяется исключительно знаком АН. Это обстоятельство имеет существенное значение для криогенной химии.
Таким образом, все три начала физической термодинамики находят в химии свою дальнейшую спецификацию. В этой связи непременно следует отметить, что химики, вводя те или иные ограничения, например уделяя особое внимание изобарно-изотермическим процессам, не ограничиваются ими. При дальнейших уточнениях некогда введенные ограничения снимаются и вводятся новые, например рассматривается изменение термодинамических функций с ростом и понижением температур реагентов. И тогда они в очередной раз убеждаются, что концептуальный аппарат химической термодинамики позволяет ориентироваться в сложном мире химических явлений. И тут же выясняется, что выводы химической термодинамики недостаточны. Они непременно должны дополняться концептуальными достижениями других химических наук, в частности химической кинетики.
Выводы
- • Закон Гесса наиболее органично выражает закон сохранения энергии применительно к химическим реакциям.
- • Важнейшее значение для химии имеют понятия энтальпии и энергии Гиббса.
- • Специфику второго начала термодинамики применительно к химическим реакциям наиболее органично выражает изменение энергии Гиббса, величина которого определяет возможность и невозможность химической реакции и химического равновесия.