Строение молекулы воды

Рассмотрим теперь взаимодействие между молекулами воды во всех трех фазах. Благодаря существованию значительного дипольного момента молекулы Н20 взаимно ориентируются друг относительно друга, испытывая взаимное притяжение или отталкивание. Уже при межмолскулярном расстоянии 10 А эти силы практически не влияют на взаимодействие молекул. Исходя из плотности водяного пара, среднее расстояние между… Читать ещё >
Строение молекулы воды (реферат, курсовая, диплом, контрольная)
Еще в 1780 г. Кавендиш и Лавуазье установили, что вода состоит из кислорода и водорода. Через 25 лет Гей-Люссак и Гумбольдт доказали, что при образовании воды взаимодействуют два объема водорода и один объем кислорода, а в 1842 г. Дюма получил весовое соотношение этих элементов в воде как 2:16. В 1929 г. был открыт стабильный изотоп кислорода 180, а в 1932 г. — дейтерий 2Н, обозначаемый буквой D. В настоящее время известны три изотопа водорода ['Н, 2Н и 3Н (тритий)) и шесть изотопов кислорода с атомной массой от 14 до 19. Стало очевидным, что естественная вода — смесь нескольких видов с различным молекулярным весом; при этом распространенность разных изотопов в молекуле Н20 такова, что сколько-нибудь заметные концентрации имеют только четыре возможные комбинации стабильных изотопов: 'Н2160 (99,73% от общей массы), 'Н2170 (0,04%), 'Н2, 80 (0,20%) и 'HDl60 (0,03%). Поскольку приготовление чистой воды с изотопным составом 'Н2|бО — очень трудная процедура, фактически все экспериментальные исследования проводились именно с природной смесью. Мы основное внимание уделим свойствам самого распространенного типа природной воды ‘Н2|60 с молярной массой 18 грамм[1], а молекулы другого изотопного состава (так называемая «тяжелая вода») будут вкратце рассмотрены в конце этой главы.
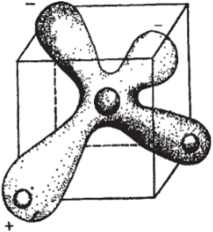
Рис. 1.1.1. Электронное облако молекулы воды
В соответствии с теорией молекулярных орбиталей, электронное облако молекулы воды имеет вид неправильного тетраэдра (рис. 1.1.1). При этом атом кислорода находится в центре, а два атома водорода — в углах. Из восьми электронов атома кислорода первая пара находится на ближайшей к ядру сферической siорбитали и прочно с ним связана, вторая пара электронов находится на более удаленной от ядра сферической Яг-орбитали и менее прочно с ним связана, третья пара электронов располагается уже не на сферической, а на круговой р-орбитали.
Оставшиеся два электрона непарные и могут взаимодействовать с электронами s1-орбитали двух атомов водорода, образуя связи О — Н. Связь О — Н за счет объединения орбит электронов вокруг сблизившихся протонов называется ковалентной. Полагается, что при таком простом объединении электронов кислорода и водорода угол между двумя связями О-Н был бы 90°. Однако из-за сил отталкивания между ядрами водорода и добавочного влияния электронов s?-орбитали (эффекта гибридизации) происходит увеличение этого угла до 104,5°.
Гибридизация электронов s2 и р-орбиталей кислорода приводит к тому, что около его ядра образуются две области заряда. В результате молекула воды приобретает тетраэдрическое строение с двумя положительно заряженными областями вблизи ядер водорода и двумя отрицательно заряженными областями вблизи ядра кислорода.
Характерное для молекулы воды расположение ядер водорода и кислорода и гибридизированных электронов приводит к тому, что моменты связей О — Н и моменты ядер создают большой дипольный момент, равный 1,86D (D — дебай — единица дипольного момента, она равна 3,33−10'12 кулон-метр). Остальные электроны вклада в общий дипольный момент молекулы Н20 не дают из-за их симметричного положения относительно ядра кислорода.
При рассмотрении параметров молекулы Н20 следует иметь в виду, что ядра ее атомов постоянно колеблются около положения равновесия. Поэтому расстояние между ядрами, а следовательно, длина связей О — Н и угол между ними постоянно меняются (рис. 1.1.2). В среднем длина связи О — Н составляет 0,96 А (А — 1 ангстрем, он равен Ю*10 м), что несколько меньше, чем у льда (0,99 А). При колебаниях как длина связей, так и угол между ними могут мешпъся до 5−8%.
Полная энергия молекулы воды определяется как разность между.
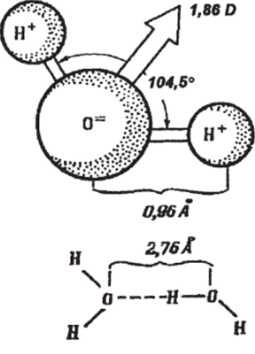
Рис. 1.1.2. Строение молекулы воды и ее дипольный момент
энергией неподвижной молекулы и ее составных частей, расположенных на бесконечном удалении друг от друга. Эта величина при 0К составляет 2081 электрон-вольт [Зацепина, 1974] или 48 000 ккал-моль'1 (1ккалмоль* =.
4187Дж-моль*1 = 233ДЖ-КГ'1).
Средняя энергия электронной связи О — Н в молекуле воды составляет примерно 110 ккал-моль1, изменение внутренней энергии ари испарения (100°С) составляет около 9 ккал-моль*1, при плавлении льда -1,4 ккал-моль'1, а тепловая энергия при температуре 0 °C — всего 0,5.
ккал-моль*1.
Рассмотрим теперь взаимодействие между молекулами воды во всех трех фазах. Благодаря существованию значительного дипольного момента молекулы Н20 взаимно ориентируются друг относительно друга, испытывая взаимное притяжение или отталкивание. Уже при межмолскулярном расстоянии 10 А эти силы практически не влияют на взаимодействие молекул. Исходя из плотности водяного пара, среднее расстояние между молекулами составляет около 30 А, поэтому 99% молекул остаются разрозненными и лишь 1% составляют димеры — объединения двух молекул Н20. /.
Во льду молекулы Н20, напротив, связаны между собой. Вследствие образования вокруг атома кислорода четырех заряженных областей, каждый атом кислорода соединяется с четырьмя другими, отстоящими от него на среднее расстояние 2,76 А, образуя тетраэдр. При этом между неподеленной парой электронов одного атома кислорода и связью О — Н другого возникает притяжение, называемое водородной связью. Эта связь сохраняется и в жидкой фазе, где ее прочность невелика — всего 5−6 ккал-моль'1 или 5% от энергии связи атомов водорода и кислорода в молекуле воды. Но при этом она оказывается гораздо большей, нежели тепловая энергия молекул Н20 (около 0,6 ккал/моль при температуре 25°С) и определяет их ориентацию и подвижность. Именно наличие водородных связей приводит к аномальности свойств жидкой воды по сравнению с другими соединениями — ее аналогами.
- [1] Молем любого вещества называется число единиц массы (например, граммов, килограммов), равное молекулярной массе вещества. Так, один 1рамм-мольводы равен 18 грамм. Один моль вещества содержит одно и то же количествомолекул 6,023−1023, названное числом Авогадро.