Реакции обнаружения катионов первой аналитической группы

Как очевидно из таблицы, присутствие катиона NHJ мешает обнаружению катиона калия, так как он дает осадки с NaHC4H406 и Na3, неотличимые по виду от соответствующих осадков, образуемых калием. Следовательно, перед обнаружением калия ион аммония должен быть удален из раствора. Для этого исследуемый раствор подкисляют азотной или соляной кислотой, выпаривают в фарфоровой чашке, а образовавшийся… Читать ещё >
Реакции обнаружения катионов первой аналитической группы (реферат, курсовая, диплом, контрольная)
К 1-й аналитической группе относятся катионы Na К*, NH4+, Mg2" и некоторые другие. Большинство солей этих катионов хорошо растворимо в воде. Поэтому группового реагента, осаждающего все четыре катиона, не существует. При систематическом анализе катионы натрия, калия и магния определяются в последнюю очередь, так как катионы других групп мешают их обнаружению и должны быть предварительно удалены. В водных растворах все катионы этой группы бесцветны.
Ион NII4 близок по свойствам к катиону К' и образует несколько аналогичных малорастворимых солей. Очень важно, что соли аммония в отличие от солей натрия и калия разлагаются при нагревании и, следовательно, могут быть удалены прокаливанием. Все соли NH4 легко гидролизуются, тогда как из солей калия и натрия гидролизу подвергаются только соли слабых кислот.
Магний отличается от остальных катионов 1-й аналитической группы рядом свойств. Так, гидроксид магния Mg (OII)9 и карбонат гидроксомагния (Mg0H)2C03 подобно аналогичным соединениям катионов 2-й аналитической группы плохо растворимы в воде. Однако они растворимы в избытке солей аммония, поэтому магний остается в растворе с катионами 1-й группы при осаждении катионов 2-й группы групповым реагентом.
Натрий
А) Реакция с гексагидроксостибиататом^У) калия
Гексагидроксостибиат (У) калия K[Sb (OH)6] образует с растворами солей натрия белый кристаллический осадок гексагидроксостибиата (У) натрия:

Описание опыта. К 2—3 каплям раствора соли натрия прибавляют равный объем реактива и трут стеклянной палочкой внутреннюю поверхность стенок пробирки для ускорения образования осадка. Эта реакция не отличается высокой чувствительностью (предельное разбавление 1: 3300).
Условия выполнения реакции. Реакцию можно выполнять только в нейтральной среде (pH = 7) и на холоде. В кислой среде вместо кристаллического осадка может выделяться белый аморфный осадок метасурьмяной кислоты HSb03, что не дает оснований для вывода о наличии ионов натрия в растворе. Прежде чем делать вывод об отсутствии иона натрия в растворе, нужно дать содержимому пробирки постоять 10—15 мин. Ионы аммония, магния и катионов 2-й аналитической группы мешают его обнаружению.
Б) Микрокристаллоскопическая реакция с ацетатом уранила
Описание опыта. На сухое предметное стекло помещают каплю раствора соли натрия и осторожно выпаривают досуха. Помещают рядом каплю раствора ацетата уранила U02(CII3C00)9b разбавленной уксусной кислоте и смешивают палочкой реактив с сухим остатком. Через 1—2 мин образуются кристаллы ацетата натрия-уранила NaCH3C00U02(CH3C00)2, имеющие вид желтоватых тетраэдров или октаэдров, хорошо различимых под микроскопом.
Эта реакция специфична для натрия, однако в присутствии больших количеств магния могут получаться похожие кристаллы тройной соли: ацетат натрия-магния-уранила NaCH3COOMg (CH3COO)2 • 31Ю2(СН3СОО)2 • 9Н20. Открываемый минимум для нее — около 1 мкг Na.
Калий
А) Реакция с гексанитрокобальтатом (Ш) натрия
Гексанитрокобальтат (Ш) натрия Na3[Co (N02)6] осаждает из раствора ион калия в виде желтого кристаллического осадка двойной соли калия и натрия: 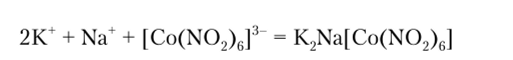
Описание опыта. К 2—3 каплям раствора соли калия прибавляют 3 капли свежеприготовленного реактива и трут стеклянной папочкой о стенки пробирки. Выпадает желтый кристаллический осадок. Реакция достаточно чувствительна, предельное разбавление для нее 1:13 000.
Условия выполнения реакции. Катион калия этим реактивом нужно определять в нейтральном или уксуснокислом растворе, не содержащем солей аммония, которые с гексанитрокобальтатом (Ш) натрия образуют аналогичный желтый кристаллический осадок. Соли аммония из раствора должны быть предварительно удалены прокаливанием.
Б) Реакция с гидротартратом натрия
Гидротартрат натрия NaHC4H406 выделяет из нейтральных растворов солей калия белый мелкокристаллический осадок гидротартрата калия:

Описание опыта. К 4—5 каплям раствора соли калия прибавляют столько же реактива, трут палочкой о стенки пробирки и охлаждают под краном. Реакция малочувствительна, предельное разбавление 1:1000.
Условия проведения реакции. Реакцию нужно проводить в нейтральной среде. В присутствии щелочей получаются хорошо растворимые средние соли винной кислоты, в сильнокислой среде осадок также не выпадает изза образования растворимой винной кислоты. В уксусной кислоте осадок не растворяется. С повышением температуры растворимость осадка увеличивается, поэтому реакцию следует проводить на холоде. Присутствие солей аммония мешает обнаружению калия, поскольку ион аммония также образует с реактивом малорастворимый осадок. Очевидно, что перед открытием калия, ион аммония должен быть удален из раствора. Быстрому выпадению осадка способствует потирание стеклянной палочкой стенок пробирки.
Вместо гидротартрата натрия для обнаружения иона калия можно использовать винную кислоту, но в этом случае реакция обратима:

Для того чтобы сместить равновесие вправо, в раствор добавляют ацетат натрия NaCH3COO, поставляющий в результате гидролиза ионы ОН .
Магний
A) Реакция с сильным основанием
Щелочи NaOH и КОН выделяют из растворов солей магния белый аморфный осадок гидроксида магния:

Реакция может быть использована для отделения иона магния, поскольку гидроксиды остальных катионов 1-й группы хорошо растворимы в воде. Гидроксид магния растворим в кислотах и солях аммония, поэтому в присутствии иона аммония эта реакция становится ненадежной.
Описание опыта. К 2—3 каплям раствора соли магния прибавляют столько же раствора гидроксида натрия или калия. Следует обратить внимание на аморфный характер осадка Mg (OH)2.
Б) Реакция с гидрофосфатом натрия
Гидрофосфат натрия Na2PIP04 в присутствии NH4OH и NH4C1 образует с солями магния белый кристаллический осадок фосфата магния-аммония:
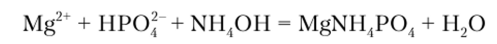
Хлорид аммония добавляют для того, чтобы не выпадал осадок гидроксида магния. Фосфат магния-аммония растворим в кислотах, поэтому реакцию выполняют в нейтральном или слабощелочном растворе.
Описание опыта. К 2—3 каплям раствора соли магния добавляют 2 капли раствора NH4C1 и 4 капли реактива Na2HP04. Затем добавляют 2 н NH4OH до появления запаха аммиака, перемешивая раствор после добавления каждой капли реактива. Из разбавленных растворов осадок выпадает не сразу, поэтому раствору дают постоять 15—20 мин.
Реакция с гидрофосфатом натрия достаточно чувствительна и чаще всего используется для открытия магния в ходе систематического анализа. Однако проведению этой реакции мешают катионы других аналитических групп, так как они тоже дают нерастворимые осадки с гидрофосфатом натрия. Поэтому эти катионы нужно предварительно удалить.
B) Реакция с карбонатом натрия
Растворимые карбонаты Na.;CO:i и К.;СО:1 выделяют из растворов солей магния белый аморфный осадок основного карбоната:
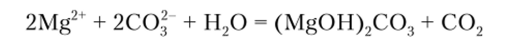
Описание опыта. К 2—3 каплям раствора соли магния добавляют равный объем раствора карбоната натрия или калия и убеждаются, что осадок осномвного карбоната магния растворим в кислотах и солях аммония).
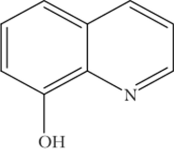
- Г) Реакция с 8-оксихиполипом
- 8-оксихинолин имеет формулу HCtJH6NO и представляется следующим образом:
8-оксихинолин из аммиачных растворов солей магния выделяет зеленовато-желтый кристаллический осадок оксихинолята магния:

Осадок растворим в кислотах; он образуется только в присутствии аммонийной буферной смеси (pH = 9,5-Н2,5).
Описание опыта. К 2 каплям раствора соли магния добавляют 1 каплю насыщенного раствора NH4C1, 2 капли концентрированного NH4OH и затем 3 капли 5%-ного спиртового раствора оксихинолина. Перемешивают содержимое пробирки и наблюдают образование осадка. Катионы 1-й и 2-й групп выполнению реакции не мешают.
Аммоний
Ион аммония мешает определению натрия и калия, поэтому перед обнаружением этих элементов его надо удалить, пользуясь летучестью солей аммония при прокаливании или способностью его реагировать в щелочных, нейтральных и слабокислых средах с формальдегидом с образованием осадка уротропина: 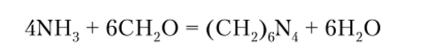
Л) Реакция с сильными основаниями
Сильные основания КОН, NaOH и др. выделяют из солей аммония при нагревании газообразный аммиак:
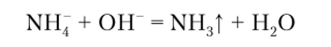
Описание опыта. К 2—3 каплям раствора соли аммония прибавляют 3—4 капли щелочи и ставят на водяную баню. Выделение аммиака можно обнаружить по запаху, но лучше воспользоваться для этого индикаторной бумагой или бумагой, пропитанной нитратом ртути (1) IIg2(N03)2. Выделяющийся аммиак окрашивает влажную индикаторную бумагу в цвет, характерный для слабощелочного раствора, а бумагу с нитратом ртути — в черный цвет.
Б) Реакция с реактивом Несслера
Реактив Несслера — это смесь тетраиодомеркурата (П) и гидроксида калия: K2[HgI4] и КОН. При реакции с солями аммония образуется краснобурый осадок иодида оксодимеркураммония, растворимый в избытке солей аммония:

Структурное строение этого осадка.

Описание опыта. К одной капле разбавленного раствора соли аммония прибавляют 2—3 капли реактива Несслера (реактив нужно брать в избытке). Реакция чрезвычайно чувствительна и показывает присутствие даже случайных примесей NH4
Результаты действия важнейших реагентов на катионы 1-й группы приведены в табл. 3.3.
Таблица 33
Реакции катионов 1-й группы.
Реагенты. | Катионы. | |||
к; | Na+ | nh; | Mg2+ | |
NaHC4H406 | Белый кристаллический осадок. | Белый кристаллический осадок. | ||
Na3[Co (N02)G]. | Желтый кристаллический осадок. | Желтый кристаллический осадок. | ||
K[Sb (OH)ti]. | Белый кристаллический осадок. | Белый аморфный осадок. | Белый кристаллический осадок. | |
U02(CH3C00)2 +. + сн3соон. | *. | Желтый кристаллический осадок. | ||
КОН, NaOH. | —. | —. | Выделение аммиака. | Белый аморфный осадок. |
K2[HgIJ + кон. | —. | —. | Красно-бурый осадок. | Белый аморфный осадок. |
Na, lIP04 + + NHiOH + + NH4C1. | Белый кристаллический осадок. | |||
Оксихинолин. | —. | —. | —. | Зеленоватожелтый осадок. |
Окрашивание пламени. | Фиолетовое. | Желтое. | —. | —. |
* При большой концентрации катиона калия может образоваться осадок.
Как очевидно из таблицы, присутствие катиона NHJ мешает обнаружению катиона калия, так как он дает осадки с NaHC4H406 и Na3[Co (N02)6], неотличимые по виду от соответствующих осадков, образуемых калием. Следовательно, перед обнаружением калия ион аммония должен быть удален из раствора. Для этого исследуемый раствор подкисляют азотной или соляной кислотой, выпаривают в фарфоровой чашке, а образовавшийся сухой осадок прокаливают до полного удаления катиона аммония (проба с реактивом Несслера). Ион NH^ можно также удалить, связав его формальдегидом в уротропин. Определению натрия с помощью ацетата уранила NH| не мешает.
Ион магния обнаружению калия и натрия не мешает.