Ионное произведение воды

Для визуального определения pH растворов применяются специальные вещества, изменяющие свое строение и в связи с этим свою окраску в зависимости от кислотности среды, называемые кислотно-основными индикаторами (табл. 8.1), являющимися органическими веществами. Однако число прореагировавших молекул воды по сравнению с общим числом молекул воды незначительно. Поэтому можно считать, что концентрация… Читать ещё >
Ионное произведение воды (реферат, курсовая, диплом, контрольная)
Вода является слабым электролитом и в незначительной степени диссоциирует па ионы по уравнению.
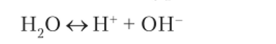
Константа диссоциации воды описывается соотношением.
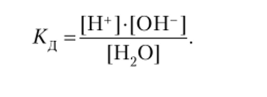
Однако число прореагировавших молекул воды по сравнению с общим числом молекул воды незначительно. Поэтому можно считать, что концентрация воды [Н20] при ее диссоциации практически не изменяется и выражение К:{ можно записать в виде.
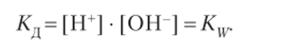
Таким образом, константа диссоциации воды является произведением концентраций ионов водорода и гидроксидионов. Она называется ионным произведением воды и обозначается Kw.
Величину Kw легко можно вычислить по уравнению AG° = -RT Kw после расчета изменения свободной энергии Гиббса в реакции диссоциации воды с привлечением табличных данных:
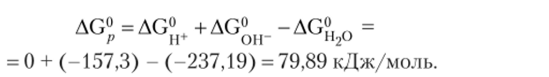
При температуре 25 °C величина lgKw равна.
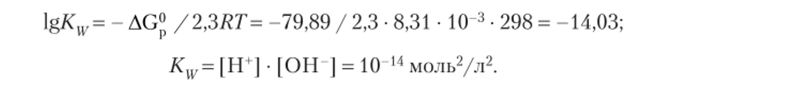
Ионное произведение воды с повышением температуры непрерывно возрастает. Так, при 100 °C величина Kw увеличивается до 5,5 • 10 13моль2/л2.
pH раствора
Значение Kw является исходной величиной для расчетов концентраций ионов Н+ и ОН в водных растворах, а также для количественной характеристики их кислотности или основности (щелочности).
Для характеризации кислотности и основности раствора введены специальные водородный (pH) и гидроксидный (рОН) показатели, представляющие собой соответственно десятичные логарифмы молярной концентрации ионов водорода или гидроксида в растворе, взятые с обратным знаком.

Для чистой воды Kw= [Н+]? [ОН ] = 10 14, [Н+] = [ОН ] = = 1() —7ирН = рОН = 7.
В кислых растворах [Н+] > [ОН ] и pH < 7. Например, в 10-3 моль/л растворе хлороводородной (соляной) кислоты концентрация ионов водорода равна [Н+] = 10~3 моль/ литр и pH = -lg 10~3 = 3.
В щелочных растворах [Н+] 7. Например, в 10~2 моль/л растворе гидроксида натрия (NaOH) концентрация ионов гидроксида равна [ОН ] = 10~2 моль/л, а ионов водорода соответственно [Н+] = Kw / [ОН ] = = 10~14 / 10~2 = 10″ 12 моль/л. Отсюда pH этого раствора равняется: pH = -IglO12 = 12.
Так как ионное произведение воды в нормальных условиях равно 10-14, то 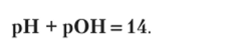
Диссоциация воды — процесс эндотермический, поэтому ионное произведение воды Kw сильно зависит от температуры. С ее повышением ионное произведение воды увеличивается, при этом увеличивается и концентрация ионов Н+ и ОН. Следовательно, изменяется и pH нейтральной среды. Если при 25 °C pH равно 7, то при 50 °C — 6,63.
Очевидно, что значения pH разбавленных растворов непосредственно зависят от концентрации кислоты или основания, а для слабых электролитов также и от их К;[.
Для сильных кислот [Н+] =ск_ты, следовательно,.
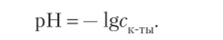
Для сильных оснований [ОН ] = сосн и рОН = — lgcocH, отсюда 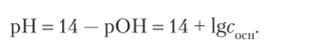
Для слабых кислот, диссоциирующих по типу.
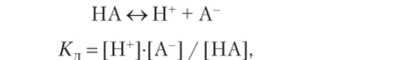
где [НА] = с, при, а —" 0. Учитывая, что [II | = [А |, можно записать /Сд? ск_ты = [Н+]2, откуда [Н'] = ^/Сд-ск.ты и соответственно.
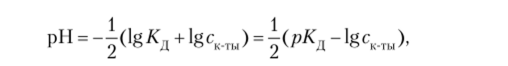
где К;. — константа диссоциации слабой кислоты.
На практике измерение pH проводят по окислительному потенциалу ионов водорода, зависящему от их концентрации. Для этого используют специальные приборы, называемые потенциометрами или рН-метрами.
Для слабых оснований можно получить или.
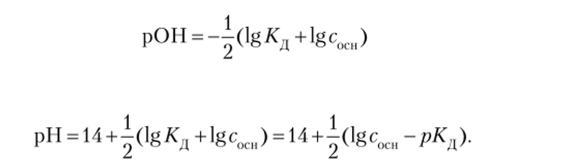
Для визуального определения pH растворов применяются специальные вещества, изменяющие свое строение и в связи с этим свою окраску в зависимости от кислотности среды, называемые кислотно-основными индикаторами (табл. 8.1), являющимися органическими веществами.
Таблица 8.1
Изменение окраски некоторых кислотно-основных индикаторов в зависимости от pH среды
Название. | Окраска индикатора в среде. | ||
кислой, [Н+]>[ОН-], pH <7. | нейтральной, [Н+] = [ОН-], pH = 7. | щелочной, [ОН-]>[Н+], pH >7. | |
Лакмус. | Красный. | Фиолетовый. | Синий. |
Фенолфталеин. | Бесцветный. | Бесцветный. | Малиновый. |
Метилоранж. | Розовый. | Оранжевый. | Желтый. |
Универсальный индикатор | Желтый —" —" Красный. | Желто-зеленый. | Зеленый —" —" Синий. |
Для более точного определения значения pH растворов используют сложную смесь нескольких индикаторов, нанесенную на фильтровальную бумагу (так называемый Универсальный индикатор Кольтгоффа). Полоску индикаторной бумаги обмакивают в исследуемом растворе, кладут на белую непромокаемую подложку и быстро сравнивают окраску полоски с эталонной шкалой для pH. Следует отметить, что фенолфталеин как индикатор окрашивается в малиновый цвет при значении pH = 8,5; метилоранж изменяет цвет с розового на желтый при pH = 3,5. Это связано с изменениями структур органических молекул индикаторов в щелочной и кислой средах.