Метилотрофия (использование одноуглеродных соединений)

К метилотрофии способны и некоторые эукариотические микроорганизмы. Метилотрофные дрожжи были открыты японскими исследователями в 1969 г. В природе они обитают в садовых почвах и существуют за счет метанола, образующегося при гидролизе пектина. Из представителей 39 проверенных родов дрожжей только пять содержали метилотрофных представителей. Это 18 видов рода Candida (наиболее изученный — С… Читать ещё >
Метилотрофия (использование одноуглеродных соединений) (реферат, курсовая, диплом, контрольная)
Использование одноуглеродных соединений микроорганизмами (метилотрофия) характеризуется определенными особенностями их метаболизма. Одноуглеродными (Ct) соединениями называют такие углеродсодержащие вещества, в состав молекулы которых входит один или несколько атомов углерода, не связанных С—С-связями.
Физиологическая группа, способная расти на одноуглеродных соединениях, называется метилотрофными микроорганизмами.
Наибольшее значение имеют такие (^-соединения, как метан, выделяемый метаногенами, метанол, образуемый при разложении пектина и лигнина, продукт смешанного брожения формиат и метиламины, получающиеся при гибели морских животных. Триметиламин образуется из N-оксида триметиламина, который синтезируется у морских обитателей как осморегулятор, поддерживающий в цитоплазме их клеток осмотическое равновесие. Поскольку это соединение является универсальным акцептором электронов (+730 мВ), то после гибели морских животных происходит его восстановление в триметиламин, имеющий запах тухлой рыбы. Формальдегид в природе в свободном виде не встречается. Формиат никогда не накапливается в больших количествах.
В анаэробных условияхсоединения используются различными группами микроорганизмов. Метан в отсутствии кислорода может окисляться до С02 только ассоциацией по крайней мере двух микроорганизмов — метаногенного архея и сульфатредуцирующей бактерии, и анаэробное окисление метана количественно связано с восстановлением сульфата. Поскольку по современным представлениям минимальное количество свободной энергии для одного организма должно составлять * 20 кДж на реакцию, то предполагают, что этот процесс может происходить следующим образом:
Д G° '(кДж/ моль).
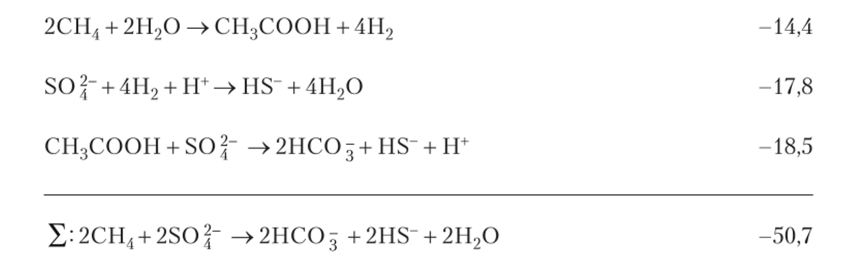
В такой системе метан — единственный источник углерода для обоих микроорганизмов, а сульфат — единственный акцептор электронов. Биохимия этого процесса пока не известна, и микроорганизмы не выделены в чистой культуре, но их систематическое положение установлено с помощью молекулярно-генетических методов.
Сравнительно недавно был открыт процесс анаэробного окисления метана, сопряженного с денитрификацией, DAMO (denitrifying anaerobic methane oxidation). Он обнаружен в морских и почвенных природных и антропогенных местообитаниях. DAMO-микроорганизмы относятся к некультивируемым формам и включены в новый филум NC10. В пробах их клетки выглядят как многоугольники, что нетипично для живой материи. Окисление метана происходит по интра-аэробному механизму, когда молекулярный кислород образуется в процессе реакции дисмутации оксида азота (NO), полученной из нитрита при участии нитритредуктазы. Часть такого эндогенного кислорода используется для окисления метана.
Метанол в анаэробной зоне используется сульфатредукторами, гомоацетогенами или метаногенами. Формиат может расщепляться самими энтеробактериями, образующими его при смешанном брожении.
Окисление метана в аэробных условиях происходит в соответствии со схемой Метилотрофы подразделяют на факультативных и облигатных. Факультативные метилотрофы способны использовать как одно-, так и многоуглеродные соединения. Облигатные метилотрофы растут только на (^-соединениях. Среди них выделяют группу, способную окислять только метан (метанотрофы). Другие одноуглеродные соединения (обычно метанол) они окисляют значительно реже и менее эффективно.
Первый метилотрофный микроорганизм Bacillus methanica (Methylomonas methanicus) был описан еще в 1906 г. До 1970 г. имелось всего пять чистых культур метилотрофов, так как их выделение представляло значительную трудность из-за постоянного присутствия микроорганизмов-спутников, например, олиготрофных бактерий рода Hyphomicrobium. Массовое получение чистых культур метилотрофов началось с развитием техники микробиологических посевов и появлением ламинарных боксов, микроманипуляторов, силикагелевых пластинок. Выделение этих микроорганизмов из отдельных колоний обычно ведут на силикагелевых пластинках, не содержащих органических соединений, тонкими иглами под микроскопическим контролем в ламинаре.
Метанотрофы отличаются высоким сродством к метану (iCCH4 = 0,1^-30 рМ) и кислороду (/е02=0,14-Ю, 18 рМ), высокой скоростью окисления метана (Vjnax= = lO-s-31 мМ СНА г-1 ч-1) и небольшой скоростью роста (р = 0,02-Ю, 07 ч-1). Они предпочитают среды с пониженным содержанием 02 (0,45—20%), являясь микроаэрофилами. Большинство из них — мезофилы и нейтрофилы, но некоторые виды растут при 62 °C, есть ацидо- (до pH 5) и алкалифильные (до pH 10) представители. Члены четырех родов способны к азотфиксации.
Метанотрофы — это грамотрицательные микроорганизмы, обладающие хорошо развитой системой внутрицитоплазматических мембран, на типе которой и строится их первичная классификация. I тип представляет собой стоики «тарелочек» и характерен для семейства Methylococcaceae. II тин этой системы состоит из мембран, параллельных ЦПМ и не пересекающих центр клетки, и встречается в семействах Methylosinaceae и Methylocystaceae. Члены родов Methylocella и Methylocapsa, входящие в семейство Beijerinckeaceae, обладают уникальной системой в виде мембранных везикул, однако их пока относят к группе, имеющей II тип мембранной системы. Все метанотрофы группируются в классы Alpha- и Gammaproteohacteria фи лума Proteobacteria. Для метанотрофов характерно наличие сложных и разнообразных поверхностных структур: капсул, трубчатых и бокаловидных выростов, микрофибрилл и регулярных слоев. Ряд важных дифференцирующих признаков родов метанотрофов перечислен в табл. 7.3.
Таблица 73
Классификация и некоторые основные свойства групп метанотрофов
I тип мембран (входят в класс Gammaproteobacteria, семейство Methylococcaceae) | ||||||
Признак. | Methylo- monas | Methylo- bacter | Methylo- COCCUS | Methylo- microbium | Methylo- sphaera | Methylo- caldium |
Форма клеток. | Палочки, большинство подвижны. | Палочки, кокки, некоторые подвижны. | Кокки, овалы, неподвижны. | Палочки, подвижны. | Кокки, неподвижны. | Палочки, кокки, некоторые подвижны. |
Стадия покоя. | Незрелые цисты. | Зрелые цисты (как у азотобактера). | Незрелые цисты. | Нет. | Нет. | Незрелые цисты. |
РубисКО. | ; | ; | ; | ; | ||
РМФ; путь. | ||||||
Сериновый путь. | ; | ; | ; | ; | ||
Мембране вязанная ММО. | ||||||
Растворимая ММО. | -/+. | +/; | -/+. | |||
ЦТК. | Неполный (без а-КГДГ). | Неполный (без а-КГДГ). | ||||
Азотфик; сация. | ; | ; | ; | ; | ; | |
Температура роста. | 25—40°С. | 20—40°С. | 37—62°С. | 20—35°С. | 0−2ГС. | 30—62°С. |
Окончание табл. 73
II тип мембран (входят в класс Alphaproteobacteria) | |||
Признак. | Семейство. | Семейство. | Семейство. |
Methylosinaceae, | Methylocystaceae, | Beijerinckeaceae, | |
род Methylosinus | род Methylocystis | род Methylocella | |
Форма клеток. | Вибриоиды,. | Вибриоиды и. | Кокки, изогнутые. |
образуют розетки,. | овалы, иногда. | палочки, непод; | |
ПОДВИЖНЫ. | образуют розетки, неподвижны. | вижны. | |
Стадия покоя. | Экзоспоры. | Липидные цисты. | Экзоспоры. |
РубисКО. | ; | ; | Нет данных. |
РМФ-путь. | ; | ; | ; |
Сериновый путь. | |||
Растворимая ММО. | V; | V; | |
Мембрансвязанная ММО. | ; | ||
ЦТК. | Полный. | Нет данных. | |
Азотфиксация. | ; | Нет данных. | |
Температура роста. | 15—35°С. | 15—35°С. | 15—35°С. |
Примечания. ММО — метанмонооксигеназа; ЦТК — цикл трикарбоновых кислот; а-КГДГ — а-кетоглутаратдегидрогеназа.
В энергетическом метаболизме первая реакция окисления метана до метанола происходит при участии фермента метанмонооксигеназы (ММО). Обычно этот фермент мембрансвязанный, растворимая форма ММО у метанотрофов встречается реже. У бактерий родов Methylocella и Methylocapsa, наоборот, присутствует только растворимая ММО и пока не обнаружена мембрансвязанная. Монооксигеназа встраивает один атом кислорода в молекулу метана, а второй с затратой двух электронов и двух протонов от донора-восстановителя идет на формирование молекулы Н20. При работе фермента расходуется энергия, которую клетка получает в дальнейших реакциях окисления с помощью дегидрогеназ метанола, формальдегида и формиата.
Метанол образуется и окисляется в периплазматическом пространстве до формальдегида е помощью дегидрогеназ двух типов. Классическая дегидрогеназа метанола, содержащая в виде простетической группы пирролохинолинхинон (ПХХ), отдает электроны на цитохром с. В этом случае имеется только один пункт сопряжения в ЭТЦ. Вторая метанолдегидрогеназа восстанавливает НАД+, и при таком процессе может быть до трех пунктов сопряжения. НАД+-зависимый фермент обнаружен у представителей рода Bacillus, растущих на метаноле и обладающих необычным для бацилл ростовым поведением — при достижении культурой стационарной фазы споры формируются только при наличии смеси аминокислот в среде, в противном случае все клетки почти мгновенно лизируются.
Окисление формальдегида может происходить в диссимиляционном цикле (рис. 7.27, а), а также по пути, в котором принимают участие тетрагидрофолат (ТГФ) или переносчики, свойственные метаногенам (рис. 7.27, 6).

Рис. 7.27. Пути окисления формальдегида у метилотрофов:
а — диссимиляционпый цикл; б — путь с участием переносчиков; ТГФ — тетрагидрофолат; Н4-МП — тетрагидрометаноптерин; МФ — метанофуран Формиат обычно окисляется НАД+-зависимыми дегидрогеназами. Окисление метиламинов идет с участием ряда ферментов до формальдегида и NH3 (рис. 7.28).

Рис. 7.28. Пути окисления метиламинов у метилотрофов:
ТМА — триметиламин; ДМА — диметиламин; МА — метиламин;
- 1 — МА-дегидрогеназа; 2 — ТМА-монооксигеназа; 3 — деметилаза N-оксида ТМА; 4 — ДМА-монооксигеназа; 5 — МА-дегидрогеназа;
- 6 — МА-оксидаза; 7 — N-метилглутаматсинтаза; 8 — у-глутамил-МА-синтаза;
- 9 — N-метилглутаматдегидрогеиаза цит сили НАД+-зависимая
Пластический обмен метилотрофов имеет характерные особенности. Ранее полагали, что субстраты сначала полностью окисляются до С02, а затем образовавшийся углекислый газ фиксируется в цикле Кальвина. На Methylosinus trichosporium было показано, что на самом деле в большинстве случаев углерод фиксируется на уровне формальдегида в особых циклах (рис. 7.29).
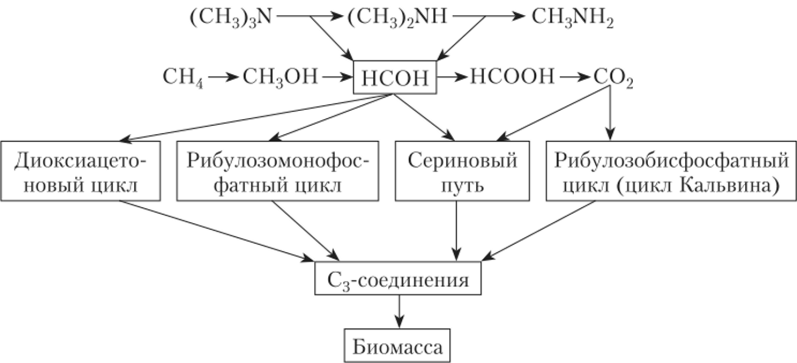
Рис. 7.29. Пути ассимиляции углерода у метилотрофов
В настоящее время известно три метилотрофных ассимиляционных цикла: рибулозомонофосфатный (РМФ) цикл (рис. 7.30), сериновый путь (рис. 7.31) и диоксиацетоновый (ДОА) цикл.
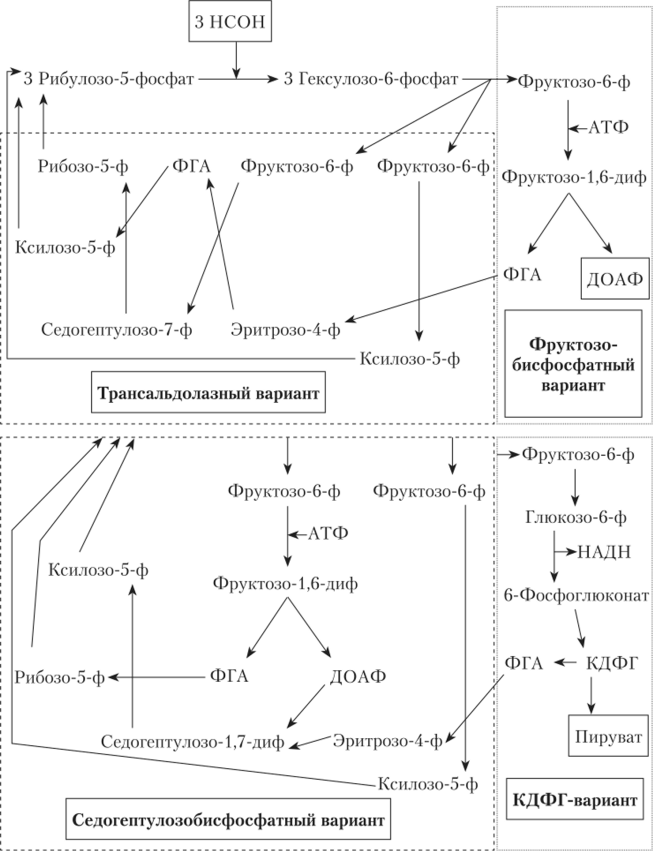
Рис. 7.30. Рибулозомонофосфатный (РМФ-) цикл ассимиляции углерода у метилотрофов.
РМФ-цикл у конкретного микроорганизма может быть представлен одним из четырех типов, сочетающих один из вариантов последовательности реакций регенерации акцептора формальдегида и один из вариантов получения С3-соединения для биосинтезов (КДФГ + грансальдолазный, фруктозобисфосфатный + седогептулозобиефосфатный, КДФГ + седогептулозобисфосфатный, фруктозобисфосфатный + трансальдолазный).
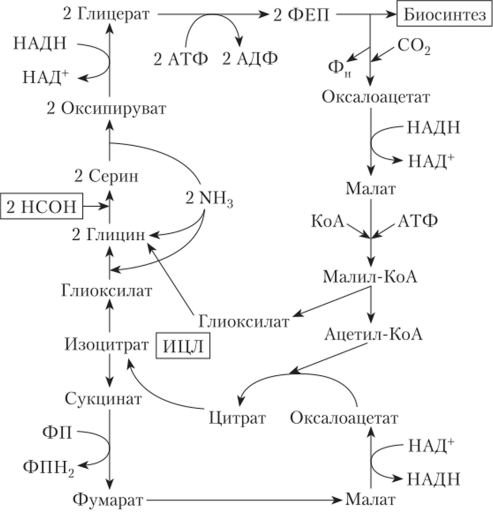
Рис. 7.31. Сериновый путь ассимиляции углерода у метилотрофов:
ИЦЛ — изоцитратлиаза В сериновом пути наряду с формальдегидом фиксируется и углекислый газ.
Цикл Кальвина может функционировать у метилотрофов как вспомогательный вдобавок к основному пути фиксации формальдегида. Таким образом, у метилотрофов формальдегид является центральным амфиболитом, используемым как в энергетическом, так и в пластическом обмене. Часть субстрата всегда окисляется до С02 с запасанием энергии, которая затем и тратится при фиксации формальдегида.
К метилотрофии способны и некоторые эукариотические микроорганизмы. Метилотрофные дрожжи были открыты японскими исследователями в 1969 г. В природе они обитают в садовых почвах и существуют за счет метанола, образующегося при гидролизе пектина. Из представителей 39 проверенных родов дрожжей только пять содержали метилотрофных представителей. Это 18 видов рода Candida (наиболее изученный — С. methylica), девять видов рода Hansenula (Я. polymorpha, Н. capsulata, Н. minuta и др.), шесть видов рода Pichia (Р. pinus, Р. pastotis и др.), а также Saccharomyces sp. и Rhodotorula sp. Sporobolomyces roseus и 5. gracilis могут расти на средах с метиламинами, используя их в качестве источника азота. Из мицелиальных грибов метилотрофами являются Gliocladium deliquescens, Paecilomyces varioti, Tnchoderma lignorum, Penicillium sp., способные к росту на средах с метанолом.
При росте на среде с метанолом у дрожжей пространство клетки заполнено пероксисомами, а все органеллы сдвинуты к одному из полюсов (рис. 7.32).

Рис. 7.32. Дрожжевая клетка с пероксисомами.
Пероксисома — это покрытая трехслойной белковой оболочкой структура, содержащая два фермента — алкогольоксидазу и каталазу (рис. 7.33).

Рис. 7.33. Использование метанола метилотрофными дрожжами:
АО — алкогольоксидаза; Кат — каталаза Алкогольоксидаза (АО) переносит два протона и два электрона от субстрата сразу на кислород с образованием перекиси, которая расщепляется каталазой (Кат). Поскольку оксидазы не восстанавливают переносчики электронов, то на первом этапе окисления субстрата дрожжи не получают энергии. Поэтому метилотрофные дрожжи проигрывают в эффективности роста метилотрофным бактериям, обладающим цит с- или НАД+зависимыми метанолдегидрогеназами. Часть образовавшегося формальдегида в пероксисоме ассимилируется в ДОА-цикле (рис. 7.34, а), а часть переносится из пероксисомы в цитоплазму, где связывается с восстановленным глутатионом и затем последовательно окисляется до С02. Ранее считали, что у метилотрофных дрожжей работает модифицированный РМФ-цикл, однако ключевой фермент этого цикла — гексулозомонофосфатдегидрогеназа, не был обнаружен. С использованием меченых веществ была получена иная схема первой в цикле реакции (рис. 7.34, б).
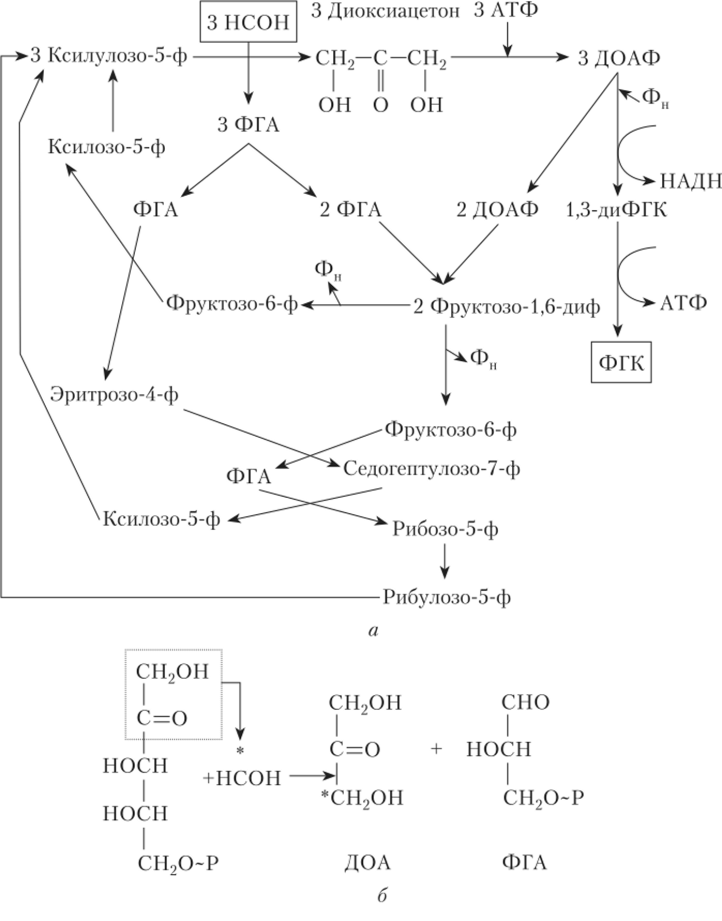
Рис. 7.34. Диоксиацетоновый (ДОА-) цикл ассимиляции формальдегида у метилотрофных дрожжей:
а — схема цикла; б — первая реакция цикла АО может составлять в клетке до 20% всех белков. Она имеет широкую субстратную специфичность к спиртам.
Метилотрофы рассматриваются как потенциальный источник пищевого и кормового белка, поскольку углерод метана и метанола очень эффективно (до 70%) включается в их биомассу. Клетки легко можно очистить от исходного питательного субстрата. Для получения белково-витаминного концентрата, используемого в качестве кормовой добавки, разработаны технологические процессы на основе метилотрофных бактерий и дрожжей. Например, компанией ICI (Великобритания) внедрен процесс производства белково-витаминного концентрата, используемого в качестве кормовой добавки Pruteen, на основе Methylophillus methylotrophus. Время генерации этого микроорганизма — 1,5 ч, при этом конверсия углерода метанола составляет 70%. Компания Shell (Великобритания/Нидерланды) пыталась организовать получение пищевого белка на смеси метана и воздуха при 7 атм. Однако работы были свернуты с началом «зеленой революции», так как соевый белок оказался дешевле и привычней. Метилотрофпые дрожжи могут быть источником кормового белка, однако, так как дрожжевая клеточная стенка не у всех животных в пищеварительном тракте расщепляется, то дрожжи перед сушкой приходится подвергать автолизу. Алкогольоксидаза метилотрофных дрожжей, имеющая широкую субстратную специфичность к спиртам, применяется для определения алкоголя в крови. Метилотрофы могут быть источником биотина, витамина В12, аминокислот тирозина и глутамата, поли-р-гидроксимасляной кислоты, полисахаридов, коферменга Q10 и т. д. Метилотрофы — перспективные объекты биоинженерии, поскольку при проточном культивировании может быть достигнута высокая плотность клеток. Системы транскрипции и трансляции метилотрофных микроорганизмов работают настолько эффективно, что при встраивании в нее нужных генов можно осуществлять сверхсинтез продукта. Так, P. pinus при выращивании в проточном ферментере на метаноле способна давать плотность до 125 г/л. Встраивая гены инсулина или интерферона человека под промотор ее АО, можно получить сверхсинтез этих продуктов.
В природе метилотрофы играют важную роль в глобальном цикле углерода. Они являются бактериальным газовым фильтром для метана, выделяемого в атмосферу метаногенными археями.