Влияние температуры на скорость реакции.
Правило Вант-Гоффа.
Уравнение Аррениуса.
Понятие об энергии активации

Энергия активации — индивидуальная характеристика каждой реакции. Реакция может произойти только в том случае, если энергия молекул реагентов достигнет величины энергии активации Ел. Для большинства химических реакций она изменяется в пределах Ел = 80-=-400 кДж/моль. На рис. 1.3 представлена энергетическая схема протекания экзотермической реакции. Для большинства реакций справедливо эмпирическое… Читать ещё >
Влияние температуры на скорость реакции. Правило Вант-Гоффа. Уравнение Аррениуса. Понятие об энергии активации (реферат, курсовая, диплом, контрольная)
Температура оказывает сильное влияние на скорость химических реакций. Например, скорость реакции 2Н2 + 02 = 2Н20 по мере повышения температуры возрастает следующим образом:
- — при 25 °C реакция не происходит;
- — при 400 °C равновесие устанавливается через 80 дней;
- — при 500 °C равновесие устанавливается через 2 часа;
- — при 600 °C происходит взрыв!
Для большинства реакций справедливо эмпирическое правило Вант-Гоффа: при увеличении температуры на каждые 10° скорость реакции возрастает в 2—4 раза. Эта величина называется температурным коэффициентом реакции или коэффициентом ВантГоффа и обозначается у:
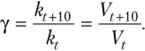
Коэффициент Вант-Гоффа позволяет легко рассчитать, во сколько раз увеличится скорость реакции при повышении температуры на (t2 — txy, по формуле.
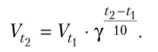
Правило Вант-Гоффа выполняется только для реакций, энергия активации которых лежит в пределах 84—170 кДж/моль. Оно было сформулировано на основе экспериментального изучения таких реакций при относительно низких температурах. Для реакций, у которых энергия активации лежит в пределах 200—400 кДж/ моль, температурный коэффициент может достигать больших величин (у = 7н-8), и правило Вант-Гоффа не выполняется.
Более строго зависимость скорости реакции от температуры описывается уравнением Аррениуса:
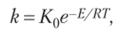
где k — константа скорости; К0 — предэкспоненциальный множитель (постоянная, не зависящая от температуры); Е — энергия активации; R — газовая постоянная; Т — абсолютная температура, К.
В логарифмической форме уравнение Аррениуса имеет вид (логарифм постоянной величины К0 будет тоже величиной постойной, обозначенной В).
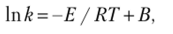
при обозначении Е/R = А уравнение принимает вид 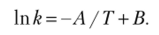
В такой форме записи очевидна прямая зависимость константы скорости от Т, т. е. константа скорости, а следовательно, и скорость реакции резко возрастают с повышением температуры.
Химические превращения происходят при соударении молекул. Число таких соударений в единицу времени даже при стандартной температуре огромно. Поэтому объяснить увеличение скорости реакции при повышении температуры простым увеличением скорости движения молекул и соответствующим увеличением количества их соударений невозможно. Очевидно, не каждое соударение приводит к химическому взаимодействию. Чтобы произошла реакция, сталкивающиеся частицы должны обладать энергией, достаточной для преодоления сил отталкивания между их электронными оболочками. Такие реакционноспособные частицы называются активными, а энергия, необходимая для преодоления энергетического барьера, — энергией активации.
Энергия активации Е.л — это тот избыток энергии (по сравнению со средней энергией), которым должны обладать молекулы реагентов, чтобы между ними произошла реакция.
Энергия активации — индивидуальная характеристика каждой реакции. Реакция может произойти только в том случае, если энергия молекул реагентов достигнет величины энергии активации Ел. Для большинства химических реакций она изменяется в пределах Ел = 80-=-400 кДж/моль. На рис. 1.3 представлена энергетическая схема протекания экзотермической реакции.
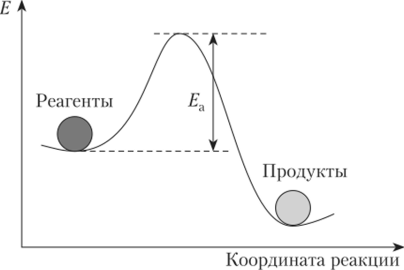
Рис. 1.3. Энергетическая схема протекания реакции.
Увеличение концентрации исходных веществ повышает вероятность столкновения активных молекул, повышение температуры увеличивает энергию реагентов, что позволяет большему числу молекул реагентов преодолеть барьер энергии активации.