Классификация молекулярных орбиталей по симметрии и их изображение

Молекулярная орбиталь ф (2а{) = с21(Is) + c22(2s) + c25(2pz) + + c26(sj-T52) при c21″ c22 и c22 > c25 > c26 соответствует главным образом вкладу фТак происходит потому, что энергия 2s-AO кислорода существенно ниже энергии его 2p-АО и энергии 1 s-AO водорода (сравните орбитальные энергии ионизации атомов, эВ: 32,38 (2sn); 15,85 (2р0); 13,06 (Ц,)). В связи с тем что МО 1 ах и 2ах должны быть… Читать ещё >
Классификация молекулярных орбиталей по симметрии и их изображение (реферат, курсовая, диплом, контрольная)
С помощью теории симметрии иногда можно определять точный состав молекулярных орбиталей в приближении МО LCAO, не проводя каких-либо квантово-химических расчетов энергии системы. Одновременно МО классифицируют по симметрии. Рассмотрим это на конкретном примере — молекуле воды. Найдем возможные МО воды, образованные базисными АО кислорода (Is, 2s, 2рх, 2рч, 2рг) и орбиталями двух атомов водорода (Is, и ls2) (рис. 16.6).
Атомные орбитали кислорода.
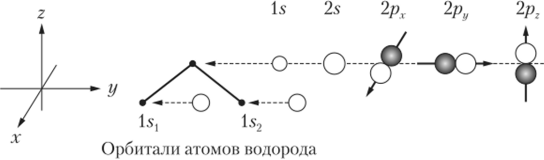
Рис. 16.6. Расположение атомов и базисных АО молекулы воды в декартовой системе координат Для удобства пронумеруем эти орбитали индексами от 1 до 7: |/, |/2, у.;, i|/4, vj/_, |/6, )г Соответствие индексов и типа орбитали дается в первом столбце табл. 16.3. Орбитали ls( и ls2 атомов водорода обозначены соответственно символами s, и s2
Таблица 16.3
Преобразование базисных орбиталей молекулы воды при операциях точечной группы C2v
Орбиталь. | Е. | С. | Щ" 1 | СТ(У*> |
(Is) или у. | V,. | У,. | у,. | у,. |
(2s) у. | V,. | У2 | У2 | у2 |
<2Рд) Уз. | Уз. | — Уз. | Уз. | — Уз. |
(2Д") Ч'4 | У 4. | " Уз. | — Уз. | Уз. |
(2Р) 'И5 | Уз. | Уз. | Уз. | Уз. |
о,) Уг,. | Уг,. | У; | У; | Уг,. |
(s2) у7 | У7 | у6 | Уб. | Ут. |
I. |
Ядерный остов молекулы относится к точечной группе симметрии С2у. В табл. 16.3 занесены результаты преобразования каждой из базисных орбиталей, получаемые под воздействием каждой из операций симметрии данной группы. При этом вращение системы вокруг оси второго порядка осуществляется по часовой стрелке. В последней строке табл. 16.3 приведены числа, показывающие, сколько раз (с учетом знака) базисная функция совпадает сама с собой при данной операции симметрии. Эти числа называются характерами приводимого представления данной системы в точечной группе симметрии C2v.
Обозначим приводимое представление символом Г. Оно состоит из неприводимых представлений группы C2v
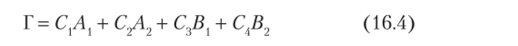
или в общем виде 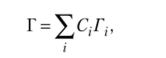
где С. — коэффициент разложения; Г = Л, Л, Вг В., — неприводимые представления.
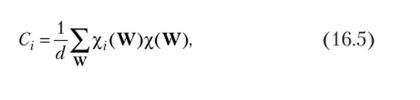
Чтобы разложить приводимое представление на неприводимые представления данной группы, существует формула приведения
где y.(W) и x (V) — соответственно характеры г-го неприводимого и приводимого представлений операции симметрии W; d — число элементов группы, называемое порядком группы.
При пользовании формулой (16.5) и вычислении порядка группы не следует забывать учитывать кратность операции симметрии, указываемую перед символом операций в таблице характеров неприводимых представлений. В нашем случае кратность всех операций симметрии равна 1. Тогда для группы C2v d = 1+1+1+1 = 4.
Выясним с помощью формулы приведения, сколько раз встречаются неприводимые представления в приводимом представлении. Для этого рассчитаем коэффициенты С. в уравнении (16.4) по формуле (16.5).
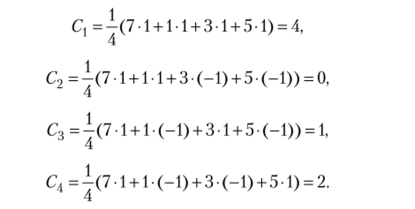
Итак, неприводимое представление Л, встречается четыре раза в приводимом представлении, А2 — не встречается, В, — встречается один раз, а В2 — два. В итоге выражение (16.4) принимает конкретный вид.

В тех случаях, когда составляющие неприводимые представления не совпадают (кратности их вхождения в разложение равны единице), составы молекулярных орбиталей системы в приближении МО LCAO могут быть полностью определены только из соображений симметрии. В нашем примере такое условие не выполняется.
Искомые линейные комбинации АО в составе МО можно получить, рассматривая преобразования базисных орбиталей молекулы под действием операций симметрии группы. Фактически такие преобразования уже приведены в строках табл. 16.3 каждого из неприводимых представлений. В приближении МО LCAO каждая МО запишется следующим образом: где N — нормирующий множитель; cv с2, …, с7 — коэффициенты разложения МО по АО, вытекающие из характера неприводимого представления и равные ±1 либо вовсе отсутствующие в разложении. При наличии k ненулевых значений С. нормирующий множитель легко определяется из условия нормировки МО
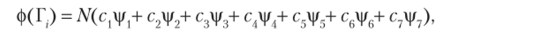
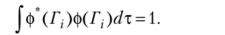
Тогда, принимая во внимание ортопормированность базисных функций vp., получаем.
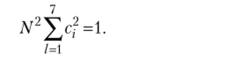
Так как имеется k ненулевых значений, с = ±1, то из по;
1 '.
следнего выражения следует, что N =—j=.
yjk
Рассмотрим МО симметрии Аг Введем генерирующий МО симметрии оператор О, проектор, который действует на базисную функцию р. каждой операцией симметрии группы C2v и затем умножает каждую получившуюся при этом функцию (со знаком) на характер неприводимого представления (в данном случае Л,) каждой операции. Действуя проектором на АО |/, первоначально получаем.
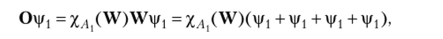
где сумма в скобках взята из 1-й строки табл. 16.3. После умножения на характеры неприводимого представления симметрии А, получаем 
Тогда нормированная МО симметрии Л, будет.
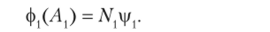
Аналогично находим, действуя проектором на функции vpv, iv |/4, vj/", |/6, |/7, что МО симметрии Л( будут иметь составы.
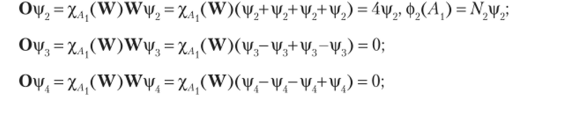
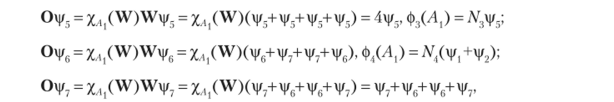
совпадает с ф4(Л,).
Таким образом, имеются четыре МО симметрии А,.

МО симметрии Л2 согласно разложению (16.6) отсутствуют.
Аналогичным образом получаем единственную МО симметрии В,.
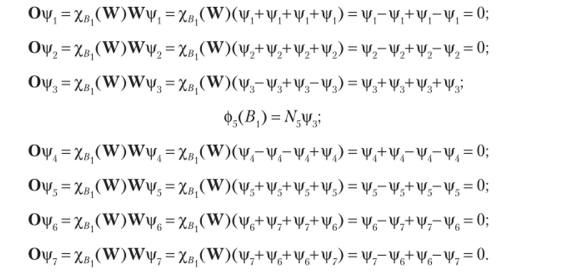
Находим оставшиеся 2 МО симметрии Вт
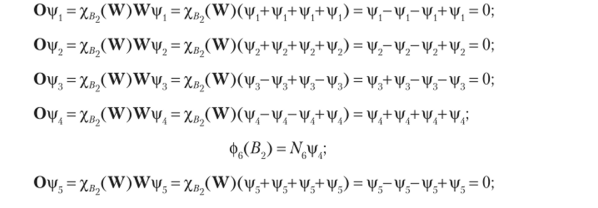
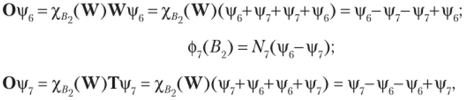
совпадает с ф_.
Все полученные МО могут быть нормированы стандартным расчетом нормирующего множителя. Проверим, соблюдается ли ортогональность МО. Рассмотрим МО симметрии А, 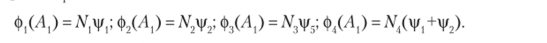
Запишем их в более наглядном виде.
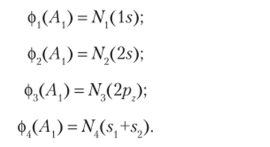
Рассмотрим интегралы перекрывания.
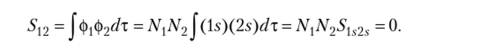
В полученном выражении символ SU2s обозначает интеграл перекрывания между l. v (O) и 2s (0) атомными орбиталями. Поскольку базисные функции ортогональны, его значение равно нулю. В результате и интеграл 5|9 равен нулю, значит, МО ортогональны. Аналогично рассмотрим ортогональность других пар МО:
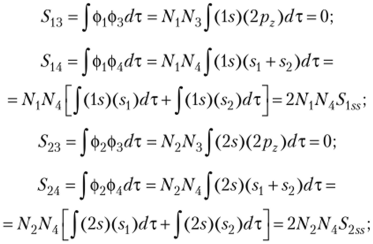
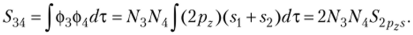
Рассмотрим МО симметрии Ву Имеется всего лишь одна МО такой симметрии: ф.(В,) = Nri. = N,{2px). Вычислением интегралов перекрывания можно убедиться в том, что МО разной симметрии всегда ортогональны между собой. Поэтому МО симметрии ортогональны МО симметрии Ву В2, а МО симметрии В, ортогональна МО симметрии В.,.
Рассмотрим МО симметрии В.,. Интеграл перекрывания между двумя МО данной симметрии запишем также в явном виде.
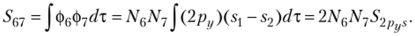
Значит, функции неортогональны.
Для получения ортогональных функций их нужно ортого нал изо ват ь.
Для ортогонализации функций часто используют процедуру ортогонализации Шмидта. Для этого из любых двух неортогональных функций ф, и <�р2 строится третья, которая является их линейной комбинацией.
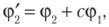
где с — коэффициент, определяемый из условия ортогональности функций ф1 и фз:
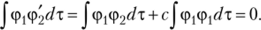
Это условие выполняется, если.
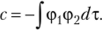
Проведем ортогонализацию орбиталей симметрии Ау Необходимо ортогонализовать функцию ффЛ,) по отношению к функциям ффЛ^, фф.^) и ф.,(Л().
Для орбиталей ффЛ,) и ффЛ ф коэффициент с = -Su (развернутое выражение для 5мсм. выше), тогда ортогональной ффЛ,) орбитали будет следующая функция:
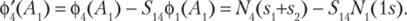
Но функция ф'(Л,) в свою очередь должна быть ортогональна и функциям ф,(Л,) и ффЛ,). Для этого ее необходимо еще дважды ортогонализовать по Шмидту Таким образом, мы получили семь ортонормированных волновых функций симметрии.
Поскольку каждой МО соответствует орбитальная энергия, то энергетические уровни системы также классифицируются по симметрии.
В квантовой химии часто возникает необходимость проанализировать вид конкретной МО. Пользуясь разложением МО по АО, это можно сделать достаточно просто и быстро. Продемонстрируем эго на примере полученных в предыдущем параграфе МО, которые для удобства приведем снова.
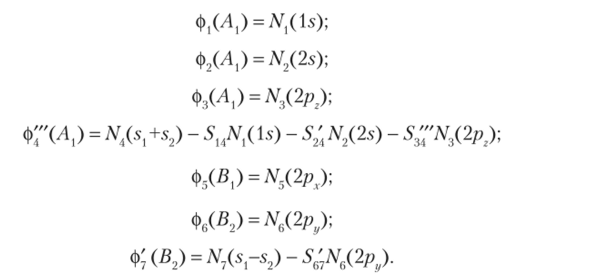
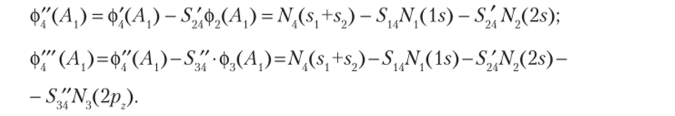
Для орбиталей симметрии Вимеем.
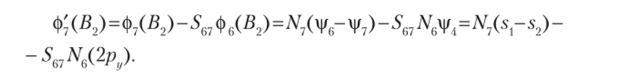
Итак, благодаря свойствам симметрии МО сгруппировались в орбитали Av В{ и В., симметрии. Как уже говорилось в параграфе 10.2, практически при квантово-химических расчетах в качестве базисных функций используются не точные атомные орбитали, а лишь их приближенные выражения. Поэтому получаемые в приближении МО LCAO молекулярные орбитали симметрии включают суперпозицию, в общем всех орбиталей конкретной симметрии. Учтем это.
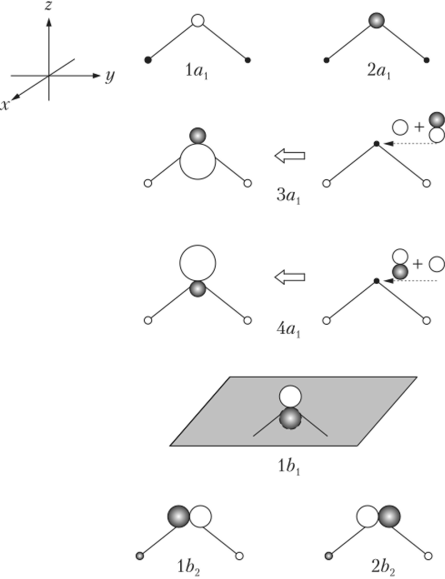
Рис. 16.7. Условное изображение МО симметрии молекулы воды.
при обсуждении составов МО и поясним происхождение их наглядных изображений на рис. 16.7.
Энергетически низшая молекулярная орбиталь 1а, имеет состав.
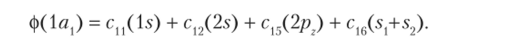
При с., «с,2, с13, с,6 она соответствует главным образом ф,(Л,) и близка по энергии и форме к 1 s-AO кислорода. Обратите внимание, что первый подстрочный индекс i у каждого коэффициента с{ является порядковым номером МО, а второй — относится к АО или их комбинации.
Составы остальных МО данной симметрии формально такие же, но отличаются они друг от друга лишь конкретными значениями коэффициентов разложения.
Молекулярная орбиталь ф (2а{) = с21(Is) + c22(2s) + c25(2pz) + + c26(sj-T52) при c21" c22 и c22 > c25 > c26 соответствует главным образом вкладу фТак происходит потому, что энергия 2s-AO кислорода существенно ниже энергии его 2p-АО и энергии 1 s-AO водорода (сравните орбитальные энергии ионизации атомов, эВ: 32,38 (2sn); 15,85 (2р0); 13,06 (Ц,)). В связи с тем что МО 1 ах и 2ах должны быть ортогональны друг другу, внешняя сферическая часть 2я, МО, являющаяся в основном 2s-AO кислорода, должна иметь иной знак, нежели его l. v-АО. Это отражено на рис. 16.7 различной заливкой контуров орбиталей.
Другая МО ф (3й,) = c31(ls) + c32(2s) + c35(2pz) + c36(s, +, s2) при c31 с32, с35, с36 соответствует положительному перекрыванию валентных орбиталей кислорода и водорода. Для этого волновые функции в области перекрывания должны иметь одинаковый знак. При этом МО является комбинацией главным образом ф2(А,), -фч(А,) и фДА^. Окончательный вид и происхождение данной МО показаны на рис. 16.7.
Последняя МО симметрии А, ф (4ал) = c41(ls) + c42(2s) + + с45(2р) + c46(s1+s2) является разрыхляющей и соответствует приблизительно тем же вкладам орбиталей, что и 3а — орбиталь, но с другими знаками (см. рис. 16.7).
Орбиталь ф (1 Ьх) = 2рх и соответствует фОна относится к неподеленной электронной паре кислорода, ориентированной перпендикулярно плоскости молекулы.
Молекулярная орбиталь ф (1 Ь2) = с64(2^) + c67(Sj-s9) отвечает связывающей для О—Н взаимодействия комбинации составляющих функций.
Другая молекулярная орбиталь симметрии В2 отвечает комбинации функций симметрии ф (2b2) = си(2р^) + c77(s-s2), разрыхляющей связь О—Н.
Нумерация МО осуществляется последовательно для орбиталей одной симметрии начиная с МО наинизшей энергии и далее в порядке увеличения ее. Качественно об относительной энергии МО можно судить по количеству узловых поверхностей (см. рис. 16.7).
Энергетическая диаграмма МО воды с одновременным изображением энергетических уровней АО изолированных атомов водорода и кислорода показана на рис. 16.8.
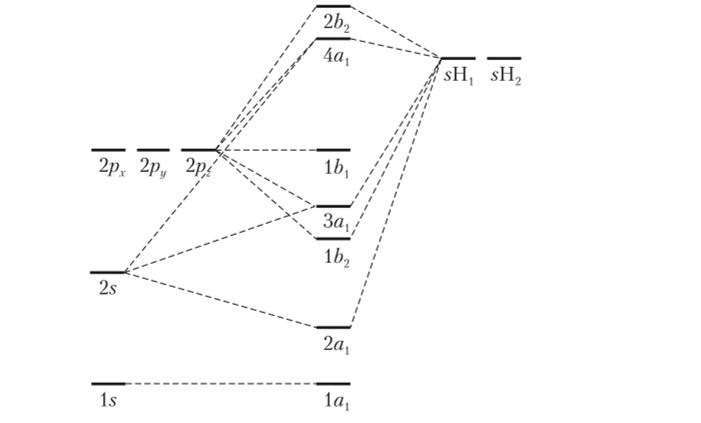
Рис. 16.8. Относительные энергии МО симметрии молекулы воды (в центральной части рисунка) и АО атомов водорода (справа) и кислорода (слева).