Растворы слабых электролитов

Из рассмотрения уравнения (13.7) становится понятным, почему электрическая проводимость слабых электролитов обратно пропорциональна квадратному корню из концентрации: такова зависимость, а от са. При увеличении концентрации вещества равновесие смещается в направлении образования молекул, в результате чего концентрация переносчиков электричества увеличивается пропорционально Jc^, т. е. меньше, чем… Читать ещё >
Растворы слабых электролитов (реферат, курсовая, диплом, контрольная)
В растворах слабых электролитов одновременно существуют как молекулы, так и ионы электролита. Между ними устанавливается состояние химического равновесия. Изотонический коэффициент растворов слабых электролитов находится в пределах от 1 до 2.
Пример 13.2. Рассчитайте изотонический коэффициент раствора слабого электролита ЛВ при степени диссоциации 20%.
Решение. Электролит распадается на два иона. Пусть с — концентрация электролита. При данной степени диссоциации концентрация каждого иона составит 0,2с, а концентрация оставшихся молекул с — 0,2с = 0,8с. Найдем суммарную концентрацию имеющихся в растворе частиц вещества:
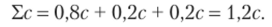
Находим изотонический коэффициент, деля суммарную концентрацию частиц на концентрацию молекул, которая была бы при отсутствии диссоциации:
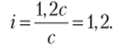
Рассмотрим условия смещения равновесия диссоциации слабого электролита на примере раствора слабой уксусной кислоты. Процесс запишем в традиционной форме диссоциации, что не влияет на рассуждения и выводы:
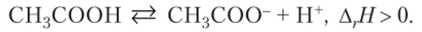
Равновесия ионизации слабых электролитов подчиняются закону действующих масс. При уменьшении концентрации электролита степень диссоциации (ионизации) увеличивается, так как равновесие смещается в сторону образования большего числа частиц, в данном случае являющихся ионами. Электролитическая диссоциация подобна газовой реакции, идущей с увеличением числа частиц. При уменьшении давления, а следовательно, и концентрации газа (с = p/(RT)) равновесие такой реакции смещается вправо.
При изменении температуры равновесие диссоциации слабого электролита смещается так же, как равновесие эндотермической химической реакции. Например, при нагревании равновесие смещается вправо, и степень диссоциации увеличивается.
Равновесие ионизации слабого электролита смещается при наличии в растворе сильного электролита, один из ионов которого одинаков с ионом слабого электролита.
Пример 13.3. Пусть порции уксусной кислоты растворены в воде и в растворах хлороводорода и ацетата натрия, как показано на рис. 13.3. В каком растворе степень диссоциации уксусной кислоты наибольшая при прочих равных условиях?
Решение. Сильные электролиты НС1 и CH3COONa дают большое число ионов и СН3СОО", одинаковых (одноименных) с ионами уксусной кислоты. Поэтому в растворах 2 и 3 равновесие диссоциации уксусной кислоты смещено влево по сравнению с раствором 1. В нем степень диссоциации наибольшая.
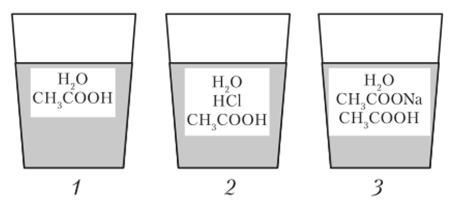
Рис. 133. Растворы уксусной кислоты в присутствии сильных электролитов.
(к примеру 13.3).
Степень диссоциации слабого электролита зависит от концентрации. В этом ее недостаток в качестве характеристики свойств электролита. Величиной, не зависящей от концентрации, является константа диссоциации К;у Это разновидность константы равновесия, относящаяся к процессам диссоциации и ионизации. Константы диссоциации слабых электролитов находят в справочных таблицах. Рассмотрим диссоциацию одной из слабых кислот — фтороводородной. Концентрацию растворенного вещества обозначим с0. Это общая концентрация. Концентрация диссоциированного вещества — сд. Ионы образуются в одинаковой концентрации, равной сд.
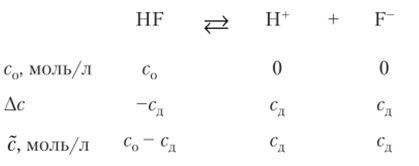
По закону действующих масс.
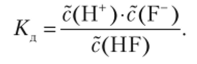
Подставляя обозначения равновесных концентраций, написанные под формулами в уравнении реакции, получим.
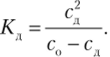
Концентрация вещества, распавшегося на ионы, выражается через степень диссоциации: сд = а • с0 (уравнение (13.4)). Подставляя в предыдущее уравнение, получим.

Уравнение (13.6) называют законом разведения Оствальда (разведение — величина, обратная концентрации). Оно связывает константу диссоциации, характеризующую свойства вещества как электролита, с концентрацией и степенью диссоциации. Для упрощения расчетов при степени диссоциации, а < 0,1 (< 10%) считают, что величиной а в знаменателе можно пренебречь, тогда.
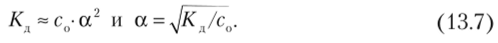
Из рассмотрения уравнения (13.7) становится понятным, почему электрическая проводимость слабых электролитов обратно пропорциональна квадратному корню из концентрации: такова зависимость а от са. При увеличении концентрации вещества равновесие смещается в направлении образования молекул, в результате чего концентрация переносчиков электричества увеличивается пропорционально Jc^, т. е. меньше, чем увеличивается сама концентрация.
Пример 13.4. Рассчитайте степень диссоциации и концентрацию ионов водорода в растворе фтороводорода с концентрацией 0,1 моль/л. Константа диссоциации K;i(IIF) = 6,310-4.
Решение. Из уравнения диссоциации слабой кислоты (см. выше) следует, что с (Н+) = Сд. Применяем уравнение (13.7):
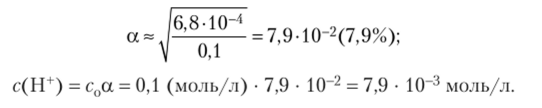
Слабые электролиты могут диссоциировать на ионы в несколько стадий, или ступенчато. Так диссоциируют, в частности, слабые кислоты.
После диссоциации первого иона Н+ образуется анион кислой соли, который тоже диссоциирует, и т. д. На каждой следующей стадии степень диссоциации уменьшается, так как отрыв протонов идет сначала от молекул, а потом от анионов с увеличивающимся отрицательным зарядом. Константа диссоциации иа каждой следующей стадии уменьшается приблизительно в 104—105 раз:
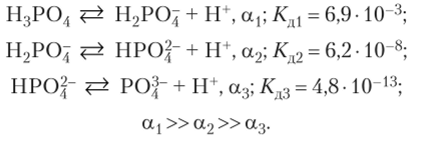
Наибольшее число ионов водорода образуется на первой стадии диссоциации кислоты, а добавочное число Н+, появляющихся на последующих стадиях, практически можно не учитывать.
Пример 13.5. В каком растворе степень диссоциации Н2РС>4 (а2) больше при прочих равных условиях: а) в растворе фосфорной кислоты; б) в растворе дигидрофосфата калия?
Решение. Эти вещества по-разному диссоциируют на первой стадии, так как кислая соль является сильным электролитом, а ее анион диссоциирует как слабый электролит: 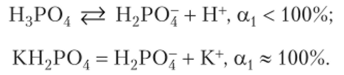
Вторая стадия диссоциации одна и та же:
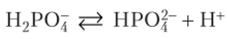
В растворе фосфорной кислоты ионы водорода, образовавшиеся на первой стадии диссоциации, смещают влево равновесие на второй стадии. Поэтому (Х2 в растворе однозамещенной соли больше, чем в растворе фосфорной кислоты.