Направленность ковалентной связи

Связь, образованная перекрыванием негибридных ри d-AO по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется пи-связью. Пи-связь может образовываться при перекрывании /?-/?-орбиталсй, p-ri-орбиталей, d-d-орбиталей (рис. 4.8), а также f-p-, f-d- и /-/-орбиталей. Соответственно, s-элементы могут образовывать только a-связи, р-элементы — аи л-связи, {/-элементы а-, ли… Читать ещё >
Направленность ковалентной связи (реферат, курсовая, диплом, контрольная)
Особенностью ковалентной связи, отличающей ее от ионной, является направленность. Ковалентные связи образуются перекрыванием электронных облаков, которые, как обсуждалось выше, направлены друг относительно друга под некоторым углом вследствие взаимного отталкивания. Валентный угол — угол между воображаемыми линиями, проходящими через ядра химически связанных атомов. В пространстве р-орбитали направлены под углом 90°, поэтому валентный угол между связями, образованными при участии р-орбиталей, должен быть близок к 90°, что и наблюдается для таких молекул, как H2S, H2Se.
В молекуле метана СН4 существуют четыре связи С—Н, имеющие одинаковые длины и энергии. Между тем у углерода в возбужденном состоянии имеются три ри одна 5-орбиталь с неспаренными электронами, которые перекрываются 5-орбиталями водорода. Исходя из этого, можно было бы ожидать, что характеристики одной из связей в молекуле метана будут отличаться от характеристик других связей. Между тем все четыре связи в молекуле метана равноценны.
Гибридизация атомных орбиталей. Американский ученый Л. Полинг выдвинул идею о гибридизации атомных орбиталей. Согласно этой идее, если у атома, вступающего в химическую связь, имеются разные атомные орбитали (АО)(5-, р-, d- или /-АО), то в процессе образования химической связи происходит гибридизация АО. То есть из разных АО образуются одинаковые (эквивалентные) АО. У атома гибридизуются орбитали, которые имеют близкие значения энергий. Идея о гибридизации АО — это удобный и наглядный прием описания сложных процессов, происходящих при образовании химических соединений. Форма гибридной АО отличается от формы исходных АО (рис. 4.3).
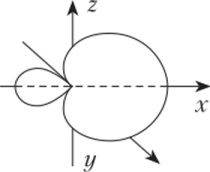
Рис. 4.3. Атомная 5/1-гибридная орбиталь.
В гибридной АО электронная плотность смещается в одну сторону от ядра. При взаимодействии гибридной орбитали с АО другого атома происходит перекрывание в области максимальной электронной плотности, что приводит к повышению энергии связи. Это повышение энергии связи компенсирует энергию, требуемую на образование гибридной орбитали. В результате химические связи, образованные гибридными орбиталями, прочнее, а полученная молекула более устойчива.
Если в химическую связь вступает атом, у которого на внешнем валентном уровне имеются один 5- и один р-электроны, то у данного атома в процессе образования связи происходит 5р-гибридизация АО (рис. 4.4).
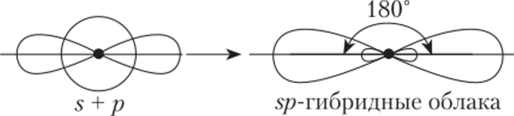
Рис. 4.4. Схема 5р-гибридизации.
В гибридизации могут участвовать один s- и два /7-электрона. При этом образуются три $р2-гибридных орбитали, направленные в пространстве под углом 120° (рис. 4.5).
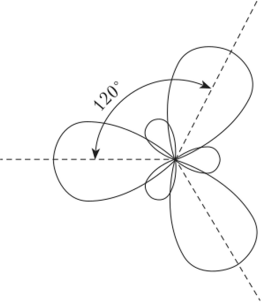
Рис. 4.5. Схема хр2-гибридизации Гибридизация одного s- и трех р-электронов ведет к образованию четырех л/73-гибридных облаков, направленных в пространстве под углом 109°28' к вершинам правильного тетраэдра (рис. 4.6).
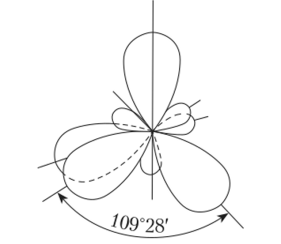
Рис. 4.6. Схема хр3-гибридизации Возможны также более сложные виды гибридизации с участием rf-орбиталей атомов (табл. 4.3).
Как следует из рис. 4.4—4.6, гибридные облака в пространстве располагаются симметрично относительно друг друга, что уменьшает их взаимное отталкивание и соответственно понижает энергию молекул.
Таблица 4.3
Пространственная конфигурация некоторых соединений
Тип гибридизации центрального атома. | Конфигурация молекулы. | Угол между связями, град. | Примеры соединений. |
sp | Линейная. | SnCl2, BeF2 | |
sp2, dp2, sd2 | Плоская тригональная. | BCI3, A1F3 | |
sp3, sd3 | Тетраэдр | 109°28'. | СН" SiH4 |
dsp2 | Плоский квадрат. | [PdBrJ. | |
dsp3 | Тригональная бипирамида. | pf5 | |
d2sp3 | Октаэдр | SFfi, [SbCU. | |
dAsp3 | Додекаэдр | [Mo (CN)e]<; |
Образование ст-, тти 8-связей. В зависимости от направления перекрывания электронных облаков образуются о-, пи 8-связи.
Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется сигма-связью. Сигма-связь может возникать при перекрывании двух s-орбиталей (рис. 4.7), s- и /7-орбиталей, /7-орбиталей между собой, «/-орбиталей, а также <1- и s-орбиталей, <7- и /7-орбиталей, а также перекрыванием гибридных орбиталей с другими видами орбиталей и между собой. Сигма-связь обычно охватывает два атома и нс простирается за их пределы, поэтому является локализованной двухцентровой связью.
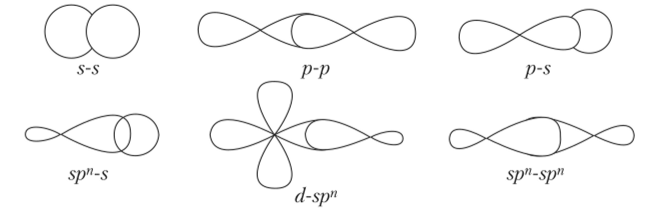
Рис. 4.7. Перекрывание атомных орбиталей при образовании
ст-связей
Связь, образованная перекрыванием негибридных ри d-AO по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется пи-связью. Пи-связь может образовываться при перекрывании /?-/?-орбиталсй, p-ri-орбиталей, d-d-орбиталей (рис. 4.8), а также f-p-, f-d- и /-/-орбиталей.
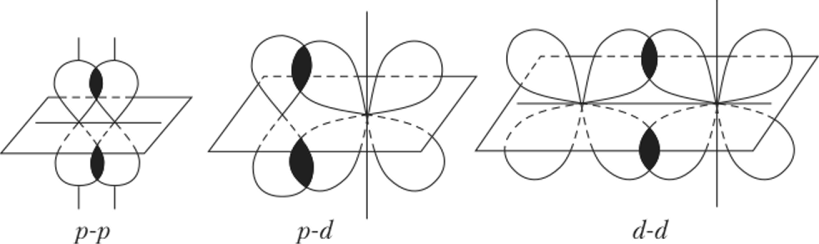
Рис. 4.8. Перекрывание атомных орбиталей при образовании.
л-связей
Связь, образованная перекрыванием d-орбиталей всеми четырьмя лепестками, называется дельта-связью (рис. 4.9).
Соответственно, s-элементы могут образовывать только a-связи, р-элементы — аи л-связи, {/-элементы а-, ли 8-связи, а /-элементы — а-, л-, 8- и еще более сложные связи. В связи с меньшим перекрыванием АО прочность у ли 8-связей ниже, чем у а-связей.
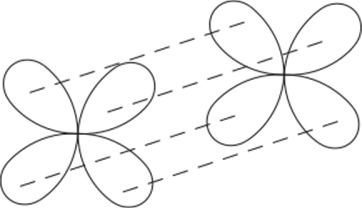
Рис. 4.9. Направление перекрывания атомных {/-орбиталей при
образовании 8-связей