Активные центры ферментов

Существует мнение, что активный центр ферментов не является постоянным, геометрически ограниченным сайтом белковой макромолекулы, а представляет собой совокупность аминокислот, взаимодействующих с субстратом, причем число химических группировок и их способность взаимодействовать с субстратом может изменяться в зависимости от природы субстрата и степени нативности фермента. Условность понятия… Читать ещё >
Активные центры ферментов (реферат, курсовая, диплом, контрольная)
У простых ферментов каталитическую функцию осуществляют непосредственно белки. В реакции с субстратом принимает участие не вся полипептидная цепь, а всего лишь несколько аминокислотных остатков, как правило, расположенных на значительном удалении друг от друга в полипептидной цепи. В процессе формирования третичной структуры происходит их сближение и стабилизация при помощи дисульфидных или множественных слабых связей. Денатурация нарушает связи, стабилизирующие третичную структуру, активный центр разрушается, и каталитические свойства фермента полностью или частично подавляются.
(J) Существует мнение, что активный центр ферментов не является постоянным, геометрически ограниченным сайтом белковой макромолекулы, а представляет собой совокупность аминокислот, взаимодействующих с субстратом, причем число химических группировок и их способность взаимодействовать с субстратом может изменяться в зависимости от природы субстрата и степени нативности фермента.
Условность понятия активный центр связана также с тем, что его не удается выделить в чистом виде. Это легко представить a priori, так как вырезание из белковой глобулы какого-то числа аминокислотных остатков однозначно приводит к денатурации и разобщению сближенных и ориентированных друг по отношению к другу химических группировок, составляющих активный центр фермента.
Различают участок, ответственный за присоединение субстрата к ферменту, т. е. центр связывания и каталитический центр, непосредственно воздействующий на субстрат.
На рис. 5.1 представлен активный центр рибонуклеазы — фермента, гидролизующего РНК, которая состоит из множества мононуклеотидов. В каталитическом центре находятся два остатка гистидина: Гис 12 и Гис 119. Оба эти гистидина участвуют в процессе катализа, причем Гис 12 образует комплекс.
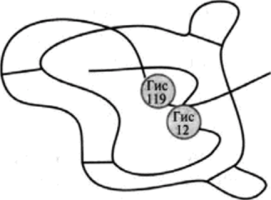
Рис. 5.1. Активный центр рибонуклеазы.
с гидроксильной группой рибозы, а Гис 119 взаимодействует с соседним фосфатом. Связь между ними при этом разрывается.
В состав активных центров многих ферментов входит ограниченное число аминокислотных остатков. К ним относятся гистидин, тирозин, цистеин, серин, лизин и в меньшей степени некоторые другие аминокислоты.
В состав активных центров сложных ферментов всегда входят простстические группы или коферменты. Иными словами, у сложных ферментов и активный центр сложный, двухкомпонентный, состоящий из аминокислотных остатков, соединенных с небелковой частью молекулы.
Идентификация аминокислотных остатков, входящих в активный центр того или иного фермента, осуществляется различными методами. Так, применение ингибиторного анализа дает возможность выявить функциональные группы, отвечающие за проявление ферментативной активности. Локализация активного центра возможна также при применении протеолитических ферментов, гидролизующих молекулу фермента на отдельные фрагменты.