Галогениды серы.
Химия

Подобно хлору, сера типичный анионоген. В атоме серы два песпарепных электрона, поэтому атомы серы могут образовывать не только двухатомные молекулы, но и цепочечные структуры. Вы должны понять, почему эти структуры сохраняются в соединениях серы. Обратите внимание на то, что соединения серы в положительных степенях окисления гораздо устойчивее соединений хлора. Если проводить реакции… Читать ещё >
Галогениды серы. Химия (реферат, курсовая, диплом, контрольная)
Кроме кислорода сера легко реагирует с фтором, хлором и бромом, но не взаимодействует с иодом. С бромом образуется S7Br2, высшее соединение с хлором — неустойчивый тетрахлорид SCl4 и только фториды известны для всех возможных степеней окисления серы, вплоть до SF6.
Свойства гексафторида серы крайне интересны. В этом соединении в образовании связей принимают участие обе доступные для гибридизации Зб/-орбитали, и связывающие электроны серы находятся на sp3d2-тибри л~ ных орбиталях, направленных к вершинам октаэдра. Высокая симметричность молекулы приводит к отсутствию дипольного момента, несмотря на большую полярность связи S—F. Отсюда слабые межмолекулярные взаимодействия, а значит, низкая температура кипения. При обычных условиях SF6 — газ. Отсутствие дипольного момента и высокий потенциал ионизации делают SF6 одним из лучших газообразных изоляторов — он используется для заполнения высоковольтных выключателей. Отсутствие доступных вакантных орбиталей, иными словами, координационная насыщенность серы в SFf. приводит к исключительной кинетической инертности этой молекулы. Несмотря на то, что реакция гидролиза.
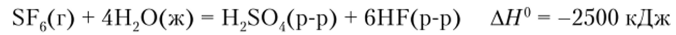
сильно экзотермична, она практически не идет даже при 100 °C, тогда как SF4 и SC14 уже моментально гидролизуются.
Общая характеристика элементов 16-й группы
Групповое название этих элементов — халькогепы («рождающие руды») — связано с тем, что типичные рудные минералы представляют собой оксиды или сульфиды металлов.
В основном состоянии атомы халькогенов имеют конфигурацию т2прл с двумя неспаренными р-электронами, и это уже в простых веществах приводит к альтернативной возможности образования либо кратной связи между двумя атомами в молекуле Э7, либо одинарной связи в цепочечных структурах.
Маленькие атомы кислорода образуют молекулы 02, серы — молекулы S8, большие атомы Se и Те связываются в цепочечные структуры.
Ширина запрещенной зоны между заполненной пр- и вакантной nd-зонами в твердых телах уменьшается по мере увеличения п. Сера в твердом состоянии — диэлектрик, Se и Те — полупроводники, а Ро образует кристаллы с металлическим характером связи.
Кислород, подобно фтору среди галогенов, значительно отличается по своим свойствам от остальных элементов группы (см. параграф 17.7), тогда как свойства селена и теллура весьма сходны со свойствами серы. Оба элемента образуют газообразные соединения с водородом Н2Э, которые, подобно H7S, умеренно растворимы в воде и ведут себя как слабые двухосновные кислоты. Их сила несколько растет по ряду H7S—H7Se— Н.Де. Из солей этих кислот растворимы только соли щелочных металлов и аммония. По этому же ряду уменьшается термодинамическая устойчивость халькогеноводородов и растут их восстановительные свойства. Так, в водных растворах потенциалы восстановления простых веществ имеют следующие значения:
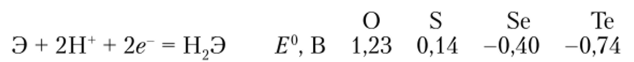
Оксиды Se и Те — Э02 и Э03 — твердые вещества, обладающие кислотными свойствами. Кислоты H2Se03 и Н2Те03 — слабые и малоустойчивые, но H2Se04 — сильная и вполне устойчивая кислота. Подобно йодной кислоте H5IOG, очень слабая теллуровая кислота существует и в виде ортоформы HGTeOG. Ионы SeO^ и ТеО< гораздо более сильные окислители, чем ион SO<. Восстановительные потенциалы этих кислот хорошо отражают вторичную периодичность в ряду S—Se—Те (см. параграф 17.7):
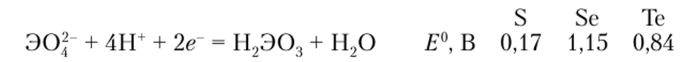
Концентрированная селеновая кислота — очень сильный окислитель.
С галогенами Se и Те взаимодействуют непосредственно, образуя в основном тетрагалогениды. Их гексафториды значительно более реакционноспособны, чем SF6. Все галогениды легко подвергаются полному гидролизу с образованием кислот (Se) или оксидов (Те):
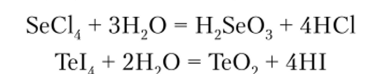
Селен и теллур, так же как и их соединения, весьма ядовиты.
Резюме
Подобно хлору, сера типичный анионоген. В атоме серы два песпарепных электрона, поэтому атомы серы могут образовывать не только двухатомные молекулы, но и цепочечные структуры. Вы должны понять, почему эти структуры сохраняются в соединениях серы. Обратите внимание на то, что соединения серы в положительных степенях окисления гораздо устойчивее соединений хлора.
Практикум
Вопросы для самоконтроля
- 1. Запишите атомные орбитали, гибридизация которых позволяет атому серы образовать шесть ковалентных связей. Почему такая гибридизация АО невозможна в случае кислорода?
- 2. Почему сероводородная вода при стоянии мутнеет?
- 3. Напишите уравнения реакций горения серы и сероводорода. Почему при этом не получается оксид серы (У1)?
Аналитические задания
- 1. Каждый из халькогенов, кроме кислорода, образует единственный гексагалогенид. Назовите его. Объясните отсутствие других гексагалогенидов.
- 2. При взаимодействии сернистой и селенистой кислот идет окислительно-восстановительная реакция. Назовите кислоту, выступающую в данной реакции в роли окислителя.
Задачи для самостоятельного решения
- 1. К 50 мл раствора иода в подкисленном растворе иодида калия прилили несколько капель раствора, содержащего сульфид, селенид и теллурид натрия. Какой из халькогенов выпадет в осадок в этих условиях?
- 2. Если проводить реакции взаимодействия серной кислоты с цинком, каждый раз увеличивая концентрацию кислоты, то в получающихся продуктах последовательно появляются: водород, сероводород, свободная сера и, наконец, оксид серь^ IV). Напишите уравнения реакций, приводящих к появлению каждого из этих веществ.
- 3. Напишите уравнения реакций восстановления серной кислоты медью и серой. Полагая, что количество кислоты в обоих случаях одинаково, найдите соотношение объемов получающегося сернистого газа.