Примеры решения задач

Раствор, содержащий в 1л 3,81 г тетрабората натрия Na2B4O7 10H2O (бура), имеет pH = 9,18. Напишите уравнение реакции гидролиза и вычислите константу первой стадии гидролиза, предполагая, что она обусловливает щёлочную среду раствора. Соли, образованные многоосновными кислотами и многокислотными основаниями, гидролизуются по ступеням. Докажите, что полная константа гидролиза равна произведению… Читать ещё >
Примеры решения задач (реферат, курсовая, диплом, контрольная)
1. Вычислить степень гидролиза цианида калия при концентрации 0,1 и 0,001 г-экв/л, если константа диссоциации HCN = 7,2 * 10−10.
Решение.
1) Запишем уравнение диссоциации HCN:
гидролиз ион диссоциация соль.
HCN H+ + CN-
KHCN =.
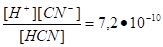
- 2) Запишем уравнение гидролиза KCN в 3-х формулах:
- а) молекулярной
KCN + H2O HCN + KOH;
б) ионно-молекулярной.
K+ + CN- + H2O HCN + K+ + OH- ;
в) в краткой ионно-молекулярной форме.
CN- + H2O HCN + OH- .
Подставляем данные значения в формулу определения степени гидролиза:
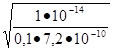
h = = = 0.0118,.
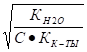
% = 0.118 100 = 1.18%; h = 1,18 .
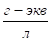
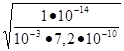
Для с= 0,001 имеем h == = 0.118.
h = 0.118 100 = 11,8%.
2. Вычислить К гидролиза, h и pH 0,1 моль/л раствора CH3COONa.
Решение:
Запишем уравнение гидролиза CH3COONCI в 3-х формулах:
а) молекулярной.
CH3COONa + H2O CH3COOH + NaOH;
б) ионно-молекулярной.
CH3COO- + Na+ + H2O CH3COOH + Na+ + OH- ;
в) краткой ионно-молекулярной.
CH3COO- + H2O CH3COOH + OH- .
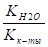
Kг = ,.
KCH3COOH = 1,74 10-5 ,.
KH2O = 10-14 ,.
Kг = = 5,7 10-10 ;
степень гидролиза h определяем по формуле.

h = = = 7,410-5 или h = 0,0076%.
[OH-]- = c h.
[OH-] = 10-1 7,6 10-6 моль;
ионное произведение воды.
[H+] [OH-] = KH2O ,.
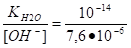
отсюда [H+] =; pH = - Ig [H+],.
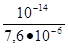
отсюда pH = - Ig? 6,88 .
3. Вычислить, чему равна константа гидролиза, h и pH 0,1 моль/л раствора фосфата натрия Na3PO4.
Решение:
Запишем уравнение гидролиза по 3-м ступеням в 3-х формах:
I ступень:
а) молекулярная.
Na3PO4 + H2O Na2HPO4 + NaOH;
- б) ионно-молекулярная
- 3Na+ + PO43- + H2O 2Na+ + (HPO4)2- + Na+ + OH- ;
- в) краткая ионно-молекулярная
PO43- + H2O HPO42- + OH- .
II ступень:
а) молекулярная.
Na2HPO4 + H2O NaH2PO4 + NaOH;
- б) ионно-молекулярная
- 2 Na+ + HPO42- + H2O Na+ + H2PO4 + Na+ + OH- ;
- в) краткая ионно-молекулярная
HPO42- + H2O H2PO4- + OH- .
III ступень:
а) молекулярная.
NaH2PO4 + H2O H3PO4 + Na+ + OH- ;
б) ионно-молекулярная.
Na+ + H2PO4- + H2O H3PO4 + NaOH;
в) краткая ионно-молекулярная.
H2PO4 + H2O H3PO4 + OH- .
Хотя ионы HPO42- и H2PO4- способны гидролизоваться, однако степени гидролиза ионов HPO42- и H2PO4- малы.
Второй и третьей стадией гидролиза можно пренебречь.
Тогда К гидролиза, h и pH раствора определяем для уравнения.
PO43- + H2O HPO4 + OH-
Из табл. 2 имеем:
KH3PO4 = 7,6 10-3,.
KH2PO4- = 6,2 10-8,.
KHPO42- = 44 10-13,.
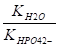
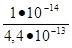
Кг = = = = 0,023.
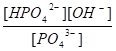
Для определения h воспользуемся формулой.
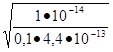
h = = = 0.377, или в процентах 37,7%.
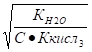
Отсюда.
[OH-] = ch = 0,1 0,377 = 3,77 10-2,.
pOH? 1,42 ,.
pH = 10 — 1,42 = 12,6 .
- 4. Как будет изменяться pH при растворении в воде солей CuCI2, Na2SO3, K2SO4 ?
- 1) Гидролиз соли CuCI2 проходит ступенчато (в основном по I ступени) по катиону Cu2+.
Первая ступень гидролиза в 3-х формах:
а) молекулярная.
CuCI2 + H2O Cu (OH)CI + HCI;
б) ионно-молекулярная.
Cu2+ + 2CI- + H2O (CuOH)+ + CI- + H+ + CI- ;
в) краткая ионно-молекулярная.
Cu2+ + H2O (CuOH)+v + H+ .
- 2. Вторая ступень гидролиза практически не протекает:
- а) молекулярная
Cu (OH)CI + H2O (CuOH)2v + HCI;
- б) ионно-молекулярная
- (CuOH)+ + CI- + H2O (CuOH)2v + H+ + CI- ;
- в) краткая ионно-молекулярная
- (CuOH)+ + H2O (CuOH)2v + H+ .
- 2) Гидролиз соли Na2SO3 гидролиз протекает по аниону.
I ступень гидролиза:
а) молекулярная.
Na2SO3 + H2O NaHSO3 + NaOH;
- б) ионно-молекулярная
- 2Na+ + SO32- + H2O Na+ + HSO3- + Na+ + OH- ;
- в) краткая ионно-молекулярная
SO32- + H2O HSO3- + OH- .
II ступень гидролиза:
а) молекулярная.
NaHSO3 + H2O H2SO3 + NaOH ;
б) ионно-молекулярная.
Na+ + HSO3-+ H2O H2SO3 + Na+ + OH- ;
в) краткая ионно-молекулярная.
HSO3-+ H2O H2SO3 + OH- .
3) Соль K2SO4 образована сильным основанием (КОН) и сильной кислотой (Na2SO4).
Гидролизу не подвергается, pH = 7.
5. Закончить уравнение реакции с учётом возможности необратимого гидролиза образуемых солей.
AI2(SO4)3 + Na2S + H2O ?
Гидролиз в данном случае идёт до конца, так как образуются осадок AI (OH)3 и газ H2S.
Уравнение гидролиза будет выглядеть следующим образом:
AI2(SO4)3 + 3Na2S + 6H2O 3Na2SO4 + 2AI (OH)3v + 3H2S^.
Вопросы и задачи.
- 1. Написать ионно-молекулярные уравнения реакции гидролиза с указанием pH при растворении в воде следующих солей: сульфата цинка, нитрата калия, хлорида цезия, сульфата хрома (III).
- 2. Написать в ионно-молекулярной форме уравнения гидролиза следующих солей: K2S, K2CO3, Li2S, K3PO4, K2SO3.
- 3. Написать в молекулярной форме уравнение гидролиза гидросолей и определить pH среды их водных растворов: NaHSO3, NaHS, KHCO3, Na2HPO4, NaH2PO4.
- 4. Написать в молекулярно-ионной форме уравнение гидролиза солей и указать реакцию их водных растворов: ZnCI2, Cu (NO3)2, FeSO4, AICI3, CrCI3.
- 5. Написать молекулярно-ионные формы уравнений гидролиза (отдельно для катиона и аниона) и указать реакцию водных растворов солей: (NH4)2S, (NH4)2SO3, (NH4)3PO4, (NH4)2HPO4.
- 6. Написать молекулярно-ионные формы уравнений гидролиза и указать реакцию водных растворов солей:
- а) NH4HS; б) NH4HSO3; в) NH4H2PO4.
- 7. Написать молекулярно-ионные формы уравнений гидролиза и указать реакцию водных растворов солей:
- а) AI (CH3COO)3; б) Fe (HCOO)3; в) Cu (CH3COO)3.
- 8. Написать в молекулярной и молекулярно-ионной форме уравнения реакций и объяснить механизм их протекания:
- а) Fe2(SO4)3 + Na2CO3 + H2O …
- б) AICI3 + (NH4)2S + H2O …
- в) Cr2(SO4)3 + (NH4)2S + H2O …
- 9. Написать в молекулярной и молекулярно-ионной форме уравнения реакций и объяснить механизм их протекания:
- а) AICI3 + CH3COONa + H2O AI (OH) (CH3COO)2 + …
- б) CuSO4 + Na2CO3 + H2O [Cu (OH)]2CO3 + …
- в) Na2SiO3 + NH4CI + H2O …
- 10. Указать, не производя вычислений, в каком из растворов двух солей равной концентрации pH больше или меньше (см. табл. 2):
- а) NaCIO4 и NaCIO ;
- б) K2S и K2Se ;
- в) Na2CO3 и NaHCO3 .
- 11. Указать, не производя вычислений, в каком из растворов двух солей равной концентрации pH больше или меньше (см. табл. 2).
- а) CH3COONa и HCOONa ;
- б) Na2CO3 и NaSO3 ;
- в) HCOONa и HCOONH4 .
- 12. Охарактеризовать поведение в растворе следующих солей и указать реакцию их водных растворов: HCOOK, NH4Br, K2HPO4, Cu (NO3)2.
- 13. Раствор NaH2PO4 имеет слабо кислую, а раствор Na3PO4 имеет сильнощёлочную реакцию. Объяснить эти факты, подтвердить уравнениями.
- 14. При сливании водных растворов Cr (NO3)3 и Na2S образуется осадок Cr (OH)3 и выделяется газ. Составить молекулярное и ионно-молекулярное уравнение реакций.
- 15. Какие из перечисленных солей подвергаются гидролизу:
- а) NaHCO3; б) NaCN; в) KNO3.
Написать молекулярные и ионно-молекулярные уравнения гидролиза.
- 16. Вычислить константу гидролиза фторида калия, определить степень гидролиза этой соли в 0,01 М растворе и pH раствора.
- 17. Вычислить pH 0,02 раствора соды Na2CO3, учитывая только первую ступень гидролиза.
- 18. Сравнить степень гидролиза соли и pH среды в 0,1 М и 0,001 М растворах цинанида калия.
- 19. При 600С ионное произведение воды КH2O = 10-12. Считая, что константа диссоциации хлориноватистой кислоты не изменяется с температурой, определить pH 0,001Н раствора KOCI при 25 и 600С.
- 20. pH 0,1 М раствора натриевой соли органической одноосновной кислоты равен 10.
Вычислить К диссоциации этой кислоты.
- 21. Исходя из значений К диссоциации соответствующих кислот и оснований, указать реакцию водных растворов следующих солей: NH4CN, NH4F, (NH4)2S.
- 22. Почему раствор NaHCO3 имеет слабощелочную среду, а NaHSO3 слабокислую реакцию? Ответ обосновать.
- 23. Вычислить константу гидролиза карбоната натрия, степень гидролиза соли в 0,1 М растворе и pH среды.
- 24. Вычислить константу гидролиза ортофосфата калия. Каков pH в 2,4 М растворе Na3PO4.Определить степень гидролиза.
- 25. Вычислить константу гидролиза ортофосфата калия. Каков pH в 3 Н растворе Na3PO4. Какова степень гидролиза?
- 26. Вычислить константу гидролиза сульфита натрия, степень гидролиза и pH 0,6 М раствора.
- 27. Вычислите pH 0,2 М раствора NaHCOO, если KHCOOH =1,710-4.
- 28. Оцените pH раствора, полученного растворением 0,001 г NH4CI в 10 л воды. KNH4OH = 1,810-5.
- 29. В чем состоит отличие реакций гидролиза AI (CH3COO)3 и AI2S3 ?
- 30. Объясните, почему при введении в раствор FeCI3 раствора соды в осадок выпадает не карбонат железа, а его гидроксид. Напишите уравнение процессов.
- 31. Составьте уравнение реакций, протекающих в водных растворах:
- а) AICI3 + H2O
- б) AICI3 + (NH4)2S + H2O
- в) AICI3 + (NH4)2CO3 + H2O
- 32. Предполагают, что гидролиз буры протекает в 2 стадии:
B4O72- + 3H2O 2H3BO3 + 2BO2-
BO2- + 2H2O H3BO3 + OH-
Как рассчитать pH раствора буры известной концентрации ?
- 33. Вычислите pH раствора, в 5л которого содержится 20 г NH4CI, если KNH4OH = 1,8 10-5.
- 34. У какого раствора pH больше SnCI2 или SnCI4 (при одинаковых концентрациях)?
- 35. Отличается ли гидролиз AICI3 от AIF3? Ответ обосновать уравнениями.
- 36. Приведите возможные способы смещения равновесия реакций гидролиза вправо и влево.
- 37. Приготовлены растворы солей Na2CO3, FeCI3 и CuSO4. Напишите по-стадийно уравнения гидролиза. Как осуществить последнюю стадию гидролиза ?
- 38. Расположите соединения Na2CO3, NaHCO3 и NaOH в порядке увеличения pH их растворов одинаковой концентрации.
- 39. Напишите сокращенным молекулярно-ионным способом уравнения реакций гидролиза следующих солей:
FeCI3; 2) Fe2(SO4)3; 3) Fe (OH)CI2.
- 40. Напишите сокращённое молекулярно-ионное уравнение реакций гидролиза следующих солей:
- 1) NaNO3; 2) NH4NO2; 3) NH4NO3.
- 41. Напишите сокращённое молекулярно-ионное уравнение реакций гидролиза следующих солей:
- 1) Zn (NO3)2; 2) Cu (NO3)2; 3) Ca (NO2)2.
- 42. Напишите сокращённое молекулярно-ионное уравнение реакций гидролиза следующих солей:
Cu (CH3COO)2; 2) CuSO4; 3) Cu (OH)NO3.
Укажите реакцию среды.
43. Укажите способы смещения равновесия реакций гидролиза вправо:
CO32- + H2O HCO3- + OH-
HCO3- + H2O H2CO3 + OH-
- 44. Приготовлены растворы солей Na2CO3, FeCI3 и CuSO4. Напишите по-стадиям уравнения реакций их гидролиза. Как осуществить последнюю стадию гидролиза.
- 45. Какие соли железа гидролизуются сильнее: FeCI2 или FeCI3 и почему? Ответ обосновать.
- 46. Вычислите pH 0,1 М раствора NH4CI (KNH4OH = 1,8 10-5).
- 47. Раствор, содержащий в 1л 3,81 г тетрабората натрия Na2B4O7 10H2O (бура), имеет pH = 9,18. Напишите уравнение реакции гидролиза и вычислите константу первой стадии гидролиза, предполагая, что она обусловливает щёлочную среду раствора.
- 48. Вычислите константу диссоциации BeOH+
BeOH+ = Be2+ + OH-
исходя из того, что pH 2 10-2М раствора BeCI2 составляет 4,2.
- 49. Соли, образованные многоосновными кислотами и многокислотными основаниями, гидролизуются по ступеням. Докажите, что полная константа гидролиза равна произведению константы гидролиза всех ступеней гидролиза.
- 50. Вычислите pH 0,2 М раствора NaHCOO, если KNaHCOO = 1,7 * 10-4.
- 51. У какого раствора pH больше: SnCI2 или SnCI4 (при одинаковых концентрациях)?
- 52. Напишите сокращенное молекулярно-ионное уравнение реакций гидролиза следующих солей (если возможно):
NaCIO4, NH4CIO4, Na2S.
- 53. При каких условиях можно ожидать (теоретически) нейтральную реакцию среды раствора соли ?
- 54. Реакция среды водного раствора MgCI2 нейтральна. О чём это говорит?
- 55. Напишите сокращенное молекулярно-ионное уравнение реакций гидролиза следующих солей:
NaCH3COO, NH4CH3COO, Fe (OH)SO4.
56. Водные растворы HCI и FeCI3 показывают кислую среду. Это объясняется протеканием следующих процессов:
HCI + H2O = H2O+ +CI-
FeCI3 + 2H2O H3O+ + CI- + FeOHCI2
Укажите признаки сходства и различия этих процессов. Назовите процессы.
- 57. Разбавленные растворы LiJ и CsF нейтральны. По мере повышения концентрации раствор LiJ начинает показывать кислую реакцию, а раствор CsF — щёлочную. Как это объяснить ?
- 58. Предскажите реакцию среды (кислая или щёлочная) водных растворов Na3PO4, Na2HPO4 и NaH2PO4.
- 59. Напишите сокращенное молекулярно-ионное уравнение реакций гидролиза следующих солей:
Fе (NO3)3, Fe (OH)2NO3, Cu (NO3)2.
60. Определите pH 0,1 М раствора ортофосфата калия.
Варианты контрольных заданий.
Вариант. | Номер задачи. | |||