Арены, или ароматические углеводороды

Заместители с преобладающими донорными свойствами: алкилы (+1); галогены, гидроксил ОН, амин ЫН2 (+М, -I). Они повышают электронную плотность в бензольном кольце и увеличивают скорость замещения по сравнению с бензолом. За счет перераспределения я-электронов в сопряженной системе наибольший отрицательный заряд создается в о- и р-положениях, в результате чего в реакции замещения получается смесь… Читать ещё >
Арены, или ароматические углеводороды (реферат, курсовая, диплом, контрольная)
Среди гомологических рядов углеводородов арены занимают особое место, так как содержат очень устойчивый плоский углеродный цикл С6, входящий в состав не только углеводородов, но и огромного количества их производных с галогенами, кислородом, азотом, серой и другими элементами. Первым членом этого гомологического ряда является бензол С6Н6, а общая формула его гомологов — С"Н2,г_6. Из гомологов бензола наиболее часто используются толуол (метилбензол) С6Н5СН3, ксилолы (изомерные диметилбензолы) С6Н4(СН3)2, кумол (изопропилбензол) С6Н5СН (СН3)2. Радикал бензолаС(-НГ) называется фенил, а радикалСН2С6Н5 — бензил.
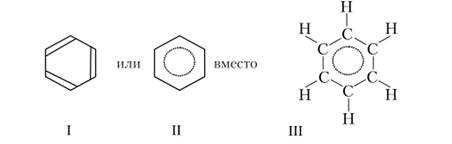
В бензольном цикле атомы углерода находятся в состоянии $р2— гибридизации. гс-Связи в молекуле бензола полностью сопряжены, поскольку в цикле нет конечных и промежуточных связей, все связи в цикле одинаковы (это выражено в формуле II). Все атомы С и Н расположены в одной плоскости. Расстояния между атомами углерода составляют 139 им, что меньше среднего арифметического из длин одинарной (154 им) и двойной (133 пм) связей. Это указывает на дополнительную стабилизацию бензольного кольца за счет сопряжения я-связей.
Формулу бензола принято записывать графически без обозначения атомов углерода и водорода, т.д.
В аренах появляется особая разновидность изомерии положения заместителей. Бензол с одним заместителем изомеров не имеет. Два заместителя в кольце, например, метальные группы в ксилолах, могут быть размещены тремя способами:
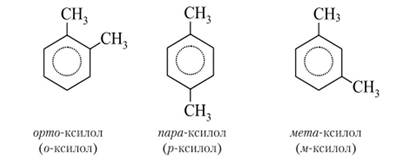
Из формул ксилолов очевидно, что положение двух заместителей у соседних атомов углерода обозначается приставкой орто-, через один атом углерода — мета-, по диаметру кольца — пара-. При составлении систематических названий аренов и их производных бензол рассматривается в качестве родоначальной структуры. Атомы углерода в кольце нумеруются от старшего заместителя в направлении ближайшего второго заместителя.
Особенности строения и реакционной способности аренов обозначаются понятием ароматичность, смысл которого сводится к следующему:
- — наличие системы сопряженных я-связей, в которых участвуют 2 +Ап электронов (п — целые числа начиная с 1);
- — атомы образуют плоский цикл, стабилизированный сопряжением; цикл с трудом участвует в реакциях присоединения, в отличие от обычных непредельных соединений;
- — на атомах цикла легко протекают реакции замещения по механизму
- •??•
К ароматическим углеводородам принадлежит и хорошо известное вещество нафталин С10Н8, состоящее из двух соединенных по ребру бензольных колец.
Пример 22.10. Докажите, что нафталин является ароматическим соединением. Решение. Нафталин изображается графической формулой.
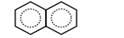
В формуле непосредственно видны 11 а-связей между атомами углерода, к которым дабавляются восемь связей С-Н. Всего получается 19 связей и 38 электронов. Все атомы углерода и водорода имеют в сумме 4• 10 + 8 = 48 валентных электронов. На л-связи остается 10 электронов. Это число удовлетворяет формуле ароматичности при п = 2.
Ответ: нафталин — ароматическое соединение.
Получение аренов. Бензол, толуол и другие арены образуются при сухой перегонке (нагревании без доступа воздуха) каменного угля. В 1 м3 получаемого газа содержится -30 1' бензола и 10 г толуола.
Выше были приведены реакции образования бензола при дегидроциклизации гексана (параграф 157) и тримеризации ацетилена (параграф 159). По реакциям этого типа получаются и некоторые из гомологов бензола.
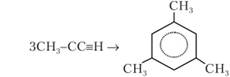
Пример 22.11. При нагревании пропина в присутствии концентрированной серной кислоты происходит его циклотримеризация. Напишите уравнение реакции. Решение.
Химические свойства аренов. Бензол горит коптящим пламенем, гак как повышенное относительное содержание углерода в молекуле способствует неполному сгоранию и образованию частиц сажи.
В гомологах бензола окисляются углеводородные радикалы. При этом разрывается связь между первым и вторым атомами углерода радикала, в результате чего независимо от состава исходных радикалов окисление идет до карбоксильной группы:
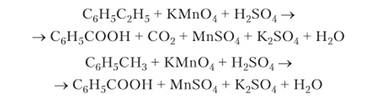
Рекомендуем составить уравнения этих реакций.
В смеси с избытком водорода в присутствии платины бензол гидрируется до циклогексана:
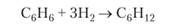
Другие реакции присоединения к бензолу идут труднее, чем присоединение по двойным связям у алкенов. Хлор реагирует с бензолом при воздействии ультрафиолетовых лучей с образованием 1,2,3,4,5,6-гексахлор-циклогексана, имеющего также название гексахлоран. Эго белое кристаллическое вещество, осаждение которого из бензольного раствора хлора впервые наблюдал М. Фарадей (1826). Гексахлоран активный инсектицид, однако он имеет серьезный недостаток: разлагается очень медленно и надолго загрязняет почву. Применение его прекращено.
Наиболее важны реакции замещения водорода в бензоле и его производных, гак как они ведут к получению очень большого количества соединений, применяющихся в качестве красителей, лекарств, дезинфицирующих средств, химикатов для сельского хозяйства. Водород замещается на атом галогена в присутствии катализатора, обладающего свойствами кислоты Льюиса, т. е. акцептора электронной пары. При реакции бензола с бромом таким катализатором может служить РеВг3. Молекула брома поляризуется, присоединяясь к катализатору:
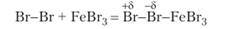
Затем частица Вг+ переносится к бензолу. Связь создается электронной парой, входящей в сопряженную систему тт-электронов бензола. Вследствие этого сопряженная система нарушается, и атом углерода, присоединивший бром, переходит в состояние 5/?3-гибридизации:
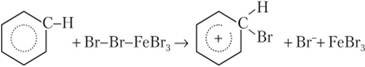
Водород Н+ переносится к любой частице в среде (например, Вг"), сопряженная я-электронная система восстанавливается, и образуется продукт замещения водорода на бром:
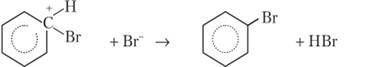
Очевидно, что реагент Вг2 использует электронную пару ароматического кольца, и поэтому реакция представляет собой электрофильное замещение (5) Практически важными реакциями бензола являются сульфирование и нитрование:
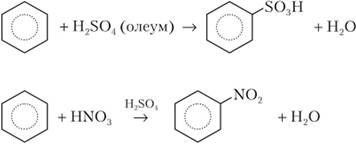
Серная кислота в последней реакции действует как катализатор, способствующий образованию электрофильных частиц N0^. Продукты этих реакций называются бензолсульфокислота и нитробензол.
Бензол реагирует с галогеналканами в присутствии безводного Л1С13 с образованием различных гомологов (реакция Фриделя Крафтса):
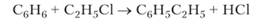
Эта реакция также идет по механизму 5 Хлорид алюминия способствует образованию карбокатионов типа С2Н5.
Реакции электрофильного замещения в гомологах и производных бензола идут с образованием разных изомеров и отличаются от замещения в самом бензоле повышенной или пониженной скоростью. Влияние имеющихся заместителей на характер замещения определяется их индуктивным и мезомерным эффектами. Различаются две группы заместителей.
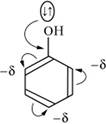
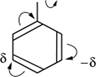
1. Заместители с преобладающими донорными свойствами: алкилы (+1); галогены, гидроксил ОН, амин ЫН2 (+М, -I). Они повышают электронную плотность в бензольном кольце и увеличивают скорость замещения по сравнению с бензолом. За счет перераспределения я-электронов в сопряженной системе наибольший отрицательный заряд создается в о- и р-положениях, в результате чего в реакции замещения получается смесь ои р-изомеров. На схеме показано смещение электронов в ароматическом кольце с заместителем гидроксогруппой:
2. Вторая группа включает заместители с преобладающими акцепторными свойствами. Они замедляют реакции замещения, так как понижают электронную плотность в кольце. Эти заместители проявляют отрицательный индуктивный и (или) мезомерный эффект. К ним относятся группыЫ02, -$Ю3Н, -СООН, -СНО, -ЫН3, -СС13 иСР3. Перераспределение л-электронов в кольце приводит к относительному повышению электронной плотности (при общем ее уменьшении) в мета-положеиш. Это поясняется схемой на примере альдегидной группы:
НС=0.
При наличии этих заместителей реакции замещения идут с образованием лг-изомеров и медленнее, чем в бензоле.