Молекулярное строение потенциал-зависимых Na+-и К+-каналов

Молекулярное устройства проводящей ионы а-субъединицы К±канала принципиально сходно с натриевой. Главное отличие заключается в том, что это — не единый четырехдоменный белок. Молекула К±канала представляет собой тетрамер, сформированный из четырех идентичных самостоятельных белковых субъединиц, каждая из которых близка по строению и молекулярной массе к отдельному (одному из четырех) доменов… Читать ещё >
Молекулярное строение потенциал-зависимых Na+-и К+-каналов (реферат, курсовая, диплом, контрольная)
Строение Na+— и К+-каналов, обеспечивающих генерацию ПД, стало предметом активного изучения сразу после того, как в конце 1980;х гг. удалось выделить их молекулы из возбудимых мембран. Было установлено, что Ыа+-канал представляет собой белковый комплекс, состоящий из нескольких субъединиц. Образующая собственно канал в мембране самая крупная а-субъединица имеет молекулярную массу примерно 270 кДа. Для нормального встраивания канала в мембрану и его функционирования необходимо присутствие и дополнительных регуляторных субъединиц (рис. 2.14).
На рис. 2.14, а показана каналообразующая а-субъединица Na^-канала, которая представляет собой белковую цепь, состоящую из четырех гомологичных последовательно соединенных белковых доменов (D{ — D4). Домены сгруппированы по кругу, образуя в центре пору для пропускания ионов натрия (рис. 2.14, б). Все четыре домена состоят из аминокислотных последовательностей, которые шесть раз пересекают мембрану. Вну;
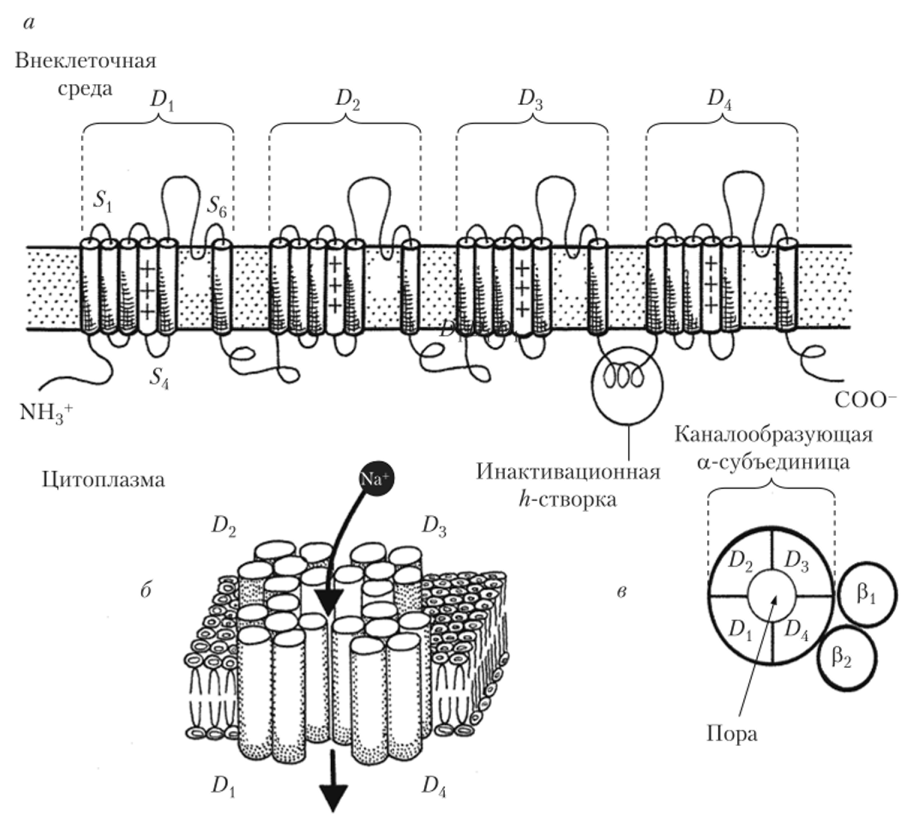
Рис. 2.14. Молекулярное устройство белкового комплекса №+-канала:
а — развернутая аминокислотная цепь капалообразующей а-субъедииицы, состоящая из четырех однотипных доменов (D{ — Z)4) (каждый домен состоит из шести внутримембранных последовательностей (S{ — 5*G); фрагмент 54, имеющий в составе много положительно заряженных аминокислотных остатков, — сенсор потенциала; неспирализованные петли (Р) между 55 и 56 — ионоселективный фильтр; б — схема взаимного расположения доменов и последовательностей в составе доменов а-субъединицы; в — схема расположения а-субъединицы и дополнительных регуляторных субъединиц pj и р2 (вид сверху) тримембранные отрезки последовательностей снирализованы и включают по 20 аминокислотных остатков. Эти участки обозначают соответственно как — 56 (от англ, sequence — последовательность). Важно отметить, что во внутримембранном фрагменте 5*4, имеющемся во всех четырех доменах канала, каждая третья аминокислота положительно заряжена (аргинин или лизин). Поэтому фрагмент SA называют сенсором напряжения. Действительно, при деполяризации мембраны происходит смещение зарядов именно во фрагменте 54, этот спиральный участок скручивается и немного смещается внутри мембраны по направлению к ее наружной стороне. Очень важна и роль фрагментов S5 и SCv которые, находясь в центре канала, выстилают его стенки и, по-видимому, играют роль nz-ворот в натриевом и n-ворот в калиевом канале.
Молекулярное устройства проводящей ионы а-субъединицы К+-канала принципиально сходно с натриевой. Главное отличие заключается в том, что это — не единый четырехдоменный белок. Молекула К+-канала представляет собой тетрамер, сформированный из четырех идентичных самостоятельных белковых субъединиц, каждая из которых близка по строению и молекулярной массе к отдельному (одному из четырех) доменов Ка+-канала. В каждой субъединице К+-канала также имеются внутримембранные спирализованные участки белковой цепи, состоящие из положительно заряженных аминокислот (54). Они, смещаясь в ответ на деполяризацию, влияют на положение внутримембранных аминокислотных последовательностей 55 и 56, что и приводит к открыванию К^-канала (рис. 2.15).
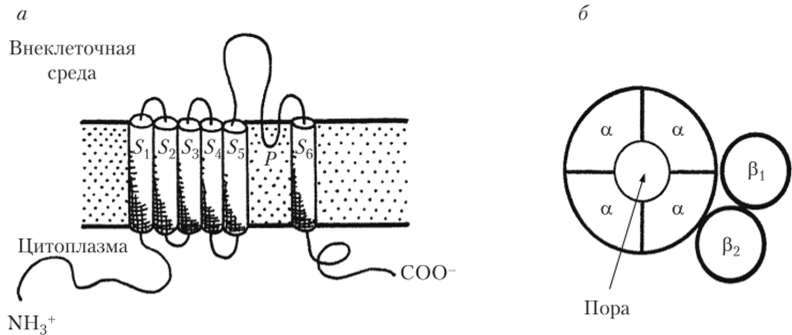
Рис. 2.15. Схема структуры потенциал-зависимого К+-канала:
для калиевых каналов характерно образование тетрамерных комплексов из четырех идентичных а-субъсдиниц (а), в каждой из которых имеются трансмембранные последовательности Si — S^c петлей Р, подобные имеющимся в Ка+-канале; у некоторых подтипов К+-каналов имеются дополнительные субъединицы р, и р2 (б), нс участвующие непосредственно в проведении тока В работах научной группы Родерика МакКиннона (1998—2003 гг.) с использованием рентгеноструктурного анализа закристаллизованного бактериального К+-канала было впервые показано, что именно наклонное (по отношению к вертикальной оси канала) положение S5- и-последовательностей и их перекрест в поре канала «запирают» канал. Это делает его недоступным для прохождения ионов калия. Предполагается, что в потенциал-зависимом канале при деполяризации происходит внутримембранное смещение сенсоров напряжения (фрагментов 54). Это вызывает конформационные изменения в сцепленных с сенсорами напряжения соседних фрагментов S5 и 5б. Сдвигаясь вслед за смещением SA, они отклоняются в стороны от поры и открывают ее (рис. 2.16). Таким образом, на сегодня описаны частицы внутри Na+— и К+-каналов, которые выполняют роль потенциал-зависимых активационных т- и я-створок. Это сенсор напряжения (фрагмент 54) и взаимодействующие с ним смещающиеся аминокислотные последовательности S5-SG.
Кроме того, в молекуле натриевого канала между доменами Ц3 и Z)4 имеется цитоплазматическая аминокислотная петля, несущая три положительно заряженные аминокислоты. Этот участок скручен в глобулу (рис. 2.17). Такая петля способна смещаться в ответ на деполяризацию мембраны, тем самым закрывая канал изнутри, со стороны цитоплазмы. Такая структура, получившая название шар па цепи (англ, ball-and-chain), играет роль инактивационных ворот (/г-створки) Na'-канала. Важно отметить, что в молекуле типичного потенциал-зависимого К+-канала отсутствует группировка шар на цени. Именно поэтому у К+-каналов задер;
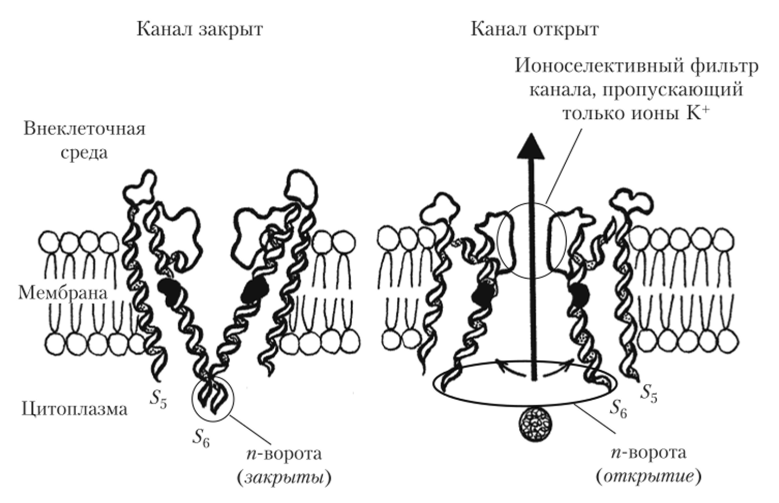
Рис. 2.16. Схема молекулярного устройства воротного механизма К+-каналов, выделенных из бактериальных мембран.
Показаны внутримембранные фрагменты молекулы бактериального К+-канала, аналогичные S5 и 56 в молекулах потенциал-зависимых Na+— и К+-каналов эукариот
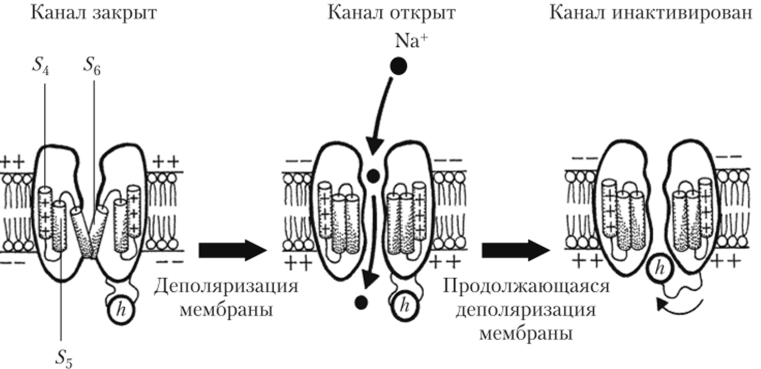
Рис. 2.17. Схема работы активационных m-ворот и инактивационных h-ворот №+-канала (продольный срез). Показаны два (из четырех) домена с фрагментами S4 — 56 (5t — 53 не показаны). Перекрест S5 и 56 перекрывает канал. Деполяризация мембраны вызывает смещение фрагментов S4 — 56, их отклонение и открывание канала. Медленное смещение А-створки в ответ на деполяризацию перекрывает.
(инактивирует) канал жанного выпрямления отсутствует способность к потенциал-зависимой инактивации.
Наличие электрически заряженных воротных частиц в составе молекулы канала, смещающихся в ответ на деполяризацию, было экспериментально подтверждено Франсиско Безаниллой и Клэем Армстронгом в работах 1975—1978 гг. Они зарегистрировали на мышечной мембране короткие (50—100 мкс) емкостные токи малой амплитуды, которые были названы асимметричными емкостными токами смещения. Эти токи возникали внутри мембраны только при ее деполяризации, но отсутствовали при гиперполяризации, т. е. фактически отражали работу воротных частиц.
Предположение о существовании /г-ворот и об их расположении у внутреннего устья Na+-канала также получило экспериментальное подтверждение в работах Иеджи Тасаки и соавторов в 1965 г. Эти ученые впервые ввели в цитоплазму гигантского аксона кальмара протеолитический фермент проназу. Проназа при введении внутрь аксона предотвращала инактивацию Ыа+-каналов, расщепляя пептидные связи между аминокислотными остатками в цитоплазматической петле, играющей роль h-створки. В результате внутриклеточного действия фермента исчезал быстрый спад Na+-TOKa. После достижения пика у Ыа+-тока вместо спада развивалась продолжительная фаза плато, свидетельствовавшая об исчезновении инактивации канала.
Важно иметь в виду, что локальная деполяризация мембраны, которая в эксперименте вызывается искусственной электрической стимуляцией мембраны, в реальных физиологических ситуациях создается деполяризационными сдвигами мембранного потенциала при генерации возбуждающих постсинаптических потенциалов (в нервных и мышечных клетках), деполяризационными рецепторными потенциалами (в отростках сенсорных нейронов) или медленными автоматическими колебаниями мембранного потенциала (в пейсмейкерных клетках).