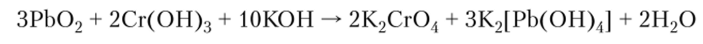Элементы подгруппы германия

Данный элемент — голубовато-серый, блестящий металл, тяжелый и очень мягкий. Практически важным свойством свинца является его способность поглощать рентгеновские лучи и радиоактивные излучения. На воздухе быстро тускнеет, покрываясь слоем оксида. Хлорид олова SnCl4 получают прямым синтезом олова с хлором. Он способен образовывать комплексное соединение с координационным числом, равным 6. Под… Читать ещё >
Элементы подгруппы германия (реферат, курсовая, диплом, контрольная)
В подгруппе германия резко различаются по свойствам полупроводник германий и два металла — олово и свинец. Эти элементы объединяет наличие 18 электронов на предпоследнем энергетическом уровне.
В подгруппе наблюдается повышение устойчивости двухвалентного состояния. Германий более устойчив в четырехвалентном, для олова характерны оба состояния, а для свинца более характерно двухвалентное.
Элементы подгруппы германия образуют соединения с органическими радикалами — металлорганические соединения, большинство из которых ядовито.
Германий Данный элемент имеет алмазоподобную кристаллическую решетку. Это темно-серое хрупкое вещество с металлическим блеском. Германий более активен, чем кремний. Он реагирует при нагревании с кислородом и галогенами, окисляется до Ge02 концентрированными серной и азотной кислотами:
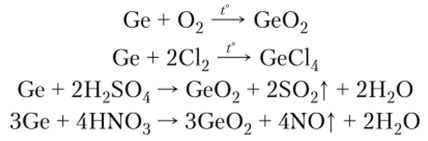
Галогениды германия практически полностью гидролизуются, но при избытке галогеноводорода устанавливается равновесие:
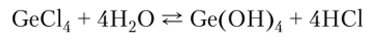
Гидроксид германия растворим в щелочах, что указывает на его амфотерность:
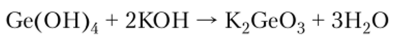
Олово Данный элемент — серебристо-белый мягкий и легкоплавкий металл. Олово интересно своими аллотропными превращениями.
При температуре ниже 13,2°С устойчива неметаллическая форма a-Sn (серое олово). Серое олово имеет алмазоподобную структуру и является изолятором, причем атомы олова находятся в состоянии $/Г}-гибридизации.
Белое олово p-Sn устойчиво при температуре выше 13,2°С, имеет слоистую структуру, обладает металлической проводимостью, причем атомы олова находятся в состоянии ^-гибридизации.
Такое различие в гибридизации и типе структуры соответствует классическим валентностям IV в сером олове и II — в белом. Если серое олово растворить в соляной кислоте, то после выпаривания образуется SnCl4-5H20, а если эту операцию повторить с белым оловом, то выделится SnCl2 • 2Н20. При температуре выше 161 °C олово переходит в третью кристаллическую разновидность (ромбическую), становится очень хрупким и растирается в порошок.
Превращение белого олова в серое, идущее при низкой температуре, называется оловянной чумой. Металл при этом рассыпается в серый порошок. Причина разрушения состоит в резком увеличении удельного объема металла (плотность p-Sn больше, чем a-Sn). Переход облегчается при контакте олова с частицами a-Sn и распространяется подобно «болезни». Наибольшую скорость распространения оловянная чума имеет при температуре -33°С; свинец и многие другие примеси ее задерживают. В результате разрушения «чумой» паянных оловом сосудов с жидким топливом в 1912 г. погибла экспедиция Р. Скотта к Южному полюсу.
Химические свойства. Разбавленные кислоты реагируют с оловом медленно с образованием солей олова (И). Соли легко подвергаются гидролизу. Гидроксид, соответствующий этой степени окисления, проявляет амфотерность, образуя станниты:

Олово (И) является сильным восстановителем. Для обнаружения ионов.
9+.
Sn используется реакция с хлоридом ртути (П). Выпадающий первоначально белый осадок в избытке восстановителя чернеет из-за образующейся ртути: 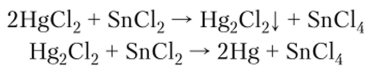
С концентрированными кислотами олово образует нерастворимое в воде белое вещество — р-оловянную кислоту. Это Sn02, связанный с переменным количеством воды, не растворяющийся ни в кислотах, ни в щелочах.

Хлорид олова SnCl4 получают прямым синтезом олова с хлором. Он способен образовывать комплексное соединение с координационным числом, равным 6. Под действием слабого основания SnCl4 образует слабую a-оловянную кислоту, проявляющую амфотерность:
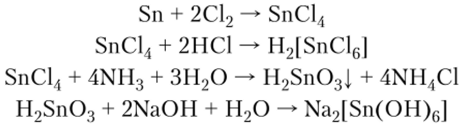
Свинец.
Данный элемент — голубовато-серый, блестящий металл, тяжелый и очень мягкий. Практически важным свойством свинца является его способность поглощать рентгеновские лучи и радиоактивные излучения. На воздухе быстро тускнеет, покрываясь слоем оксида.
Химические свойства. При нагревании свинец реагирует с серой, кислородом и галогенами: 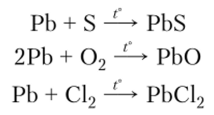
Свинец реагирует с разбавленными кислотами, если при этом образуются растворимые соли, поэтому он реагирует с разбавленной серной кислотой. При взаимодействии с концентрированной серной кислотой образуется растворимый гидросульфат, а при растворении в концентрированной соляной кислоте — комплексная кислота:
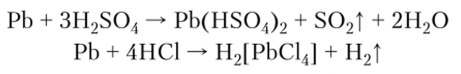
При действии щелочей на соли свинца образуется белый гидроксид, проявляющий амфотерность:
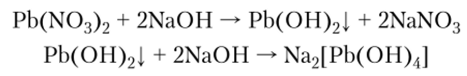
Оксид свинца (1У) — сильный окислитель, например: