Кислотно-основные свойства жидких сред организма

Степень диссоциации воды очень мала (очень слабый электролит), поэтому активность водороди гидроксид-ионов в чистой воде практически равна их концентрации. Так как вода присутствует в большом избытке, ее концентрация может считаться постоянной. Она составляет 55,6 моль/л (1000 г: 18 г/моль = 55,6 моль). Подставляя в выражение для константы диссоциации /Сл (Н20) это значение, получают новое… Читать ещё >
Кислотно-основные свойства жидких сред организма (реферат, курсовая, диплом, контрольная)
Многие электролиты, в частности гидроксиды различных элементов Э, проявляют свойства кислот или оснований.
Диссоциация гидроксида ЗОН может протекать по двум типам:

т.е. разрыв может происходить по обеим связям группы Э-О-Н.
Например, уксусная кислота.
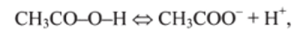
щелочь 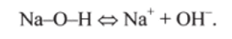
При сравнимой прочности связей О-Н и Э-О диссоциация одновременно может протекать по кислотному и основному типам:

Гидроксиды такого типа называются амфолитами. К амфолитам относится вода Н20: 
В настоящее время не существует однозначного определения понятий кислоты и основания, которое в равной мере можно было бы использовать для характеристики кислотно-основных свойств вещества в любых растворителях.
Для характеристики многих электролитов в водных растворах и в настоящее время можно использовать понятия кислоты, основания, данные Аррениусом:
Кислотой называют электролит, диссоциирующий в растворах с образованием водород-ионов Н+;
основанием называют электролит, диссоциирующий в растворах с образованием гидроксид-ионов ОН ;
амфолитом (амфотерным гидроксидом) называют электролит, диссоциирующий в растворе с образованием как водород-ионов, так и гидроксид-ионов.
К амфолитам относят аминокислоты, белки, нуклеиновые кислоты, а также гидроксиды цинка, алюминия, хрома и других амфотерных элементов.
В кислой среде амфолит проявляет основной, а в щелочной среде — кислотный характер.
Например, гидроксид цинка при взаимодействии с кислотами ведет себя как основание: 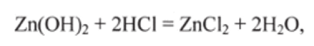
а при взаимодействии со щелочами — как кислота H2Zn02:

Таким образом, согласно теории Аррениуса свойства кислот обусловлены наличием в их растворах водород-ионов, а свойства оснований — присутствием в их растворах гидроксид-ионов. Однако такой взгляд на кислоты и основания применим только для водных растворов.
Ограниченность понятий кислоты и основания, данных Аррениусом, можно проиллюстрировать примерами. Молекула NH3 не содержит иона ОН, а молекула СО? — иона Н‘, однако в водном растворе первая проявляет свойства основания, а вторая — кислоты.
Исследования подобного типа реакций, и в особенности реакций, протекающих в неводных растворителях, привело к созданию более общих теорий кислот и оснований.
В 1923 г. И. Бренстед и Т. Лоури разработали протонную теорию кислот и оснований. Согласно ей, кислотой называют всякое вещество, молекулярные частицы которого (в том числе и ионы) способны отдавать протон, т. е. быть донором протонов; основанием называют всякое вещество, молекулярные частицы которого (в том числе и ионы) способны присоединять протоны, т. е. быть акцептором протонов.
Такие определения кислот и оснований позволяют включать в их число не только молекулы, но и ионы. Например, карбонат-ион согласно протонной теории является основанием, гак как в водном растворе он присоединяет протон: СО/ + Н+ о оНСО з. В соответствии с протонной теорией кислоты подразделяют на три типа:
1) нейтральные кислоты, например НС1, H2SO4, Н3РО4:
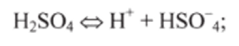
2) катионные кислоты, представляющие собой положительные ионы, например NH%. НзО+:

3) анионные кислоты, представляющие собой отрицательные ионы, например HSO 4, Н2РО 4, НРО2 4: 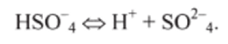
Подобного типа классификация имеется и для оснований:
1) нейтральные основания, например NH3, Н2О, С2Н5ОН:
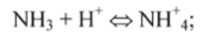
2) анионные основания, представляющие собой отрицательные ионы, например СГ, СНзСОО, ОН" :
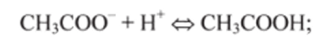
3) катионные основания, представляющие собой положительные ионы, например h2n-nhV.
Растворители типа воды, жидкого аммиака, а также анионы многоосновных кислот, которые могут быть и донорами и акцепторами протонов, являются амфолитами.
Так, в реакции 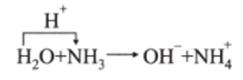
молекула воды отдает протон и является кислотой. Однако в реакции.
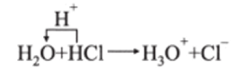
молекула воды присоединяет протон и является основанием. Таким образом, вода — типичный амфолит.
Процесс диссоциации (ионизации) вещества происходит в контакте с растворителем. При этом растворитель выполняет или функцию кислоты, или функцию основания.
Например, при растворении аммиака вода — кислота: 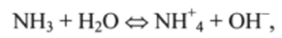 при растворении НС1 вода — основание:
при растворении НС1 вода — основание: 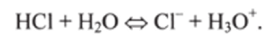
Согласно протонной теории, отдавая протон, кислота превращается в основание, которое называют сопряженным этой кислоте. Таким образом, имеются следующие варианты.
I. (Кислота) (Сопряженное основание)| + Н ,.
т.е. каждой кислоте соответствует сопряженное основание.
Наоборот, основание, присоединяя протон, превращается в сопряженную кислоту.
II. {Основание)2 + Н {Сопряженная кислота)}.
Например, кислоте СН3СООН соответствует сопряженное основание СН3СОО, основанию СГ — сопряженная кислота НС1.
Так как протон в растворах не существует в свободном виде, кислота может отдать протон только основанию, которое, приняв протон, становится кислотой. Поэтому согласно протонной теории имеет место кислотно-основное (КО) равновесие, обусловленное переносом протона:
III. {Кислота)j + (<Основание)г о {Кислота)} + {Основание).
Для краткости обратимый процесс кислотно-основного взаимодействия называют КО-равновесием.
Например: 
Реакции нейтрализации, ионизации, гидролиза с точки зрения протонной теории являются частными случаями КО-равновесий.
Реакция I типа СН3СООН + Н2О СН3СОО + Н30 протекающая в прямом направлении, представляет собой ионизацию уксусной кислоты, в обратном же направлении — нейтрализацию какого-либо ацетата, например ацетата натрия, сильной кислотой.
Реакция II типа NH% + Н2О NH3 + Н3О*, протекающая в прямом направлении, показывает гидролиз какой-либо соли аммония, а в обратном направлении — нейтрализацию аммиака сильной кислотой.
В этих кислотно-основных равновесиях вода играет роль основания. Но, будучи амфолитом в других кислотно-основных равновесиях, она может выполнять и роль кислоты, например:
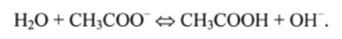
Здесь прямая реакция кислотно-основного равновесия представляет гидролиз ацетата, а обратная — реакцию нейтрализации уксусной кислоты сильным основанием.
Протолитические кислотно-основные равновесия III типа могут иметь место не только в воде, но и в других растворителях, например в безводном HF:
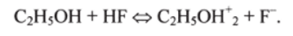
Диссоциация воды согласно теории Бренстеда протекает по уравнению.
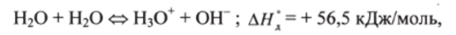
т.е. одна молекула воды отдает, а другая — присоединяет протон, происходит автоионизация воды.
Константа диссоциации воды при 298 К, определенная методом электрической проводимости, равна:

где [Н*], [ОН ], [НгО] - концентрации ионов Н ОН" и воды (для краткости вместо НзО~ в кислотно-основных равновесиях пишут Н).
Степень диссоциации воды очень мала (очень слабый электролит), поэтому активность водороди гидроксид-ионов в чистой воде практически равна их концентрации. Так как вода присутствует в большом избытке, ее концентрация может считаться постоянной. Она составляет 55,6 моль/л (1000 г: 18 г/моль = 55,6 моль). Подставляя в выражение для константы диссоциации /Сл(Н20) это значение, получают новое выражение:
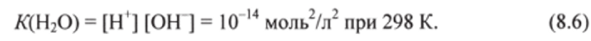
Константа /С (Н20) называется ионным произведением или константой автоионизации воды.
Согласно выражению (8.6),.
-^в чистой воде или любом водном растворе при постоянной температуре произведение концентраций (активностей) водороди гидроксид-ионов есть величина постоянная, называемая ионным произведением воды.
Константа /Г (Н20) зависит от температу ры. При повышении температуры она увеличивается, так как процесс диссоциации воды эндотермический: АЯ" = = + 56,5 кДж/моль (принцип Ле Шателье). Так, при температуре тела человека (310 К) константа К (Н20) = 3,13*10 14, а при температуре 373 К возрастает до 5,9−1 (Г13.
В чистой воде при 298 К концентрации ионов Н+, ОН" равны [Н>] = =[ОН ] = 1 -10-7 моль/л, как это следует из равенства (8.6).
В растворах разных веществ в соответствии с законом действующих масс константа К (Н20) имеет то же значение, что и для чистой воды.
Растворы, в которых [Н+] = [ОН-], называют нейтральными.
Если к чистой воде добавить столько щелочи, чтобы концентрация гидроксидионов повысилась, например, до 10 4 моль/л, то, по Ле Шателье, равновесие диссоциации воды сместится и концентрация [Н*] понизится до 10″ ш моль/л, так что по закону действующих масс ионное произведение воды останется равным КГ14 моль2/л2.
Наоборот, если к чистой воде добавить столько кислоты, чтобы концентрация водород-ионов повысилась, например, до 10-? моль/л, то концентрация гидроксидионов понизится до 10″ моль/л и ионное произведение воды опять станет равным КГ14 моль2/л2.
Из этих примеров видно, что концентрации (точнее, активности) гидроксиди водород-ионов взаимозависимы. Зная концентрацию одного из этих ионов, всегда можно рассчитать концентрацию другого. Поэтому кислотность и щелочность раствора можно оценить количественно концентрацией одного из этих ионов.
В качестве характеристики кислой реакции среды часто используют концентрации водород-ионов, но на практике это не очень удобно. Поэтому обычно для данной цели используют отрицательный десятичный логарифм концентрации водород-ионов, называемый водородным показателем pH среды (pH от англ, power Hydrogene — сила водорода):
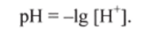
Например, если [Н+] = 10″? моль/л (кислая среда), то pH = 3, а если [Н*] = 10 9 моль/л (щелочная среда), то pH = 9. В нейтральной среде [Н4] = 10_г моль/л и pH =7.
Из этих примеров следует, что в нейтральной среде [Н4] = 10~7 моль/л, pH = 7,0; в кислой среде [Н+] > 10″7 моль/л, pH < 7,0; в щелочной среде [Н ] < 10″ 7 моль/л, pH > 7,0.
Реакцию среды можно охарактеризовать и гидроксильным показателем, т. е. отрицательным десятичным логарифмом концентрации гидроксид-ионов:
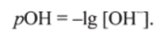
Если взять отрицательный десятичный логарифм выражения ионного произведения воды, получим или 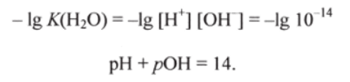
В растворах сильных кислот и оснований pH показатели кислотности и основности могут быть рассчитаны по формулам.
pH = -lg с (кислота); /ЮН = -lg с (основание).
В растворах слабых кислот НА кислотно-основное равновесие III типа имеет вид.
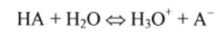
или 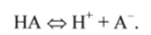
Константа кислотной диссоциации Ка равна.
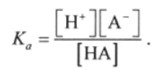
Здесь [Н~] = [А ], потому что в соответствии с реакцией при диссоциации НА образуется один ион Н и один ион, А. [НА] = с (НА) — [Н‘], где с (НА) — исходная концентрация кислоты при ее растворении. Подставляя это значение в уравнение для Kq, при с (НА), равной или больше 0,01, получают выражение для расчета концентрации водород-ионов в растворе слабой кислоты:
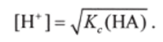
Взяв отрицательный десятичный логарифм обеих частей этого уравнения, получают 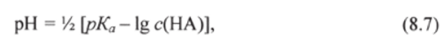
где рКа = -lg Ка.
В растворе слабых оснований В кислотно-основное равновесие III типа имеет вид 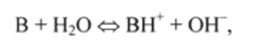
где В — основание, а ВН+ — сопряженная В кислота. Константа основности (КО) равновесия в этом случае в соответствии с законом действующих масс равна.

Константу Кь называют константой диссоциации основания В. Например, когда при диссоциации образуются гидроксид-ионы то 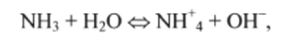
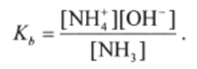
Согласно теории Бренстеда основанию В соответствует сопряженная кислота ВН Поэтому сила основания в водном растворе может определяться и константой кислотной диссоциации сопряженной кислоты.
Действительно, константа кислотной диссоциации Ка для сопряженной кислоты ВН" равна 
Например, для диссоциации аммоний-иона 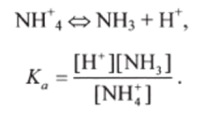 Перемножая выражения для Ка и Кь" получают.
Перемножая выражения для Ка и Кь" получают.
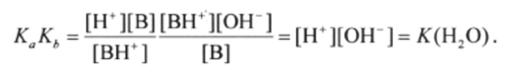
Таким образом, величины Ка и Кь для сопряженной кислотно-основной пары связаны простым соотношением (Т= 298 К):
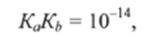
или или 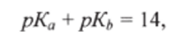
отсюда 
Таким образом, сила кислот и оснований может быть выражена в общей шкале значений рКа, подобно тому, как реакция среды характеризуется водородным показателем pH.