Растворимость газов в жидкостях.
Законы Генри, Дальтона и Сеченова

А — растворение газа в жидкости. б — растворение газа в крови; р (Х|) — парцнальнос давление вещества Х| в газе, с (Х|) — концентрация ттого вещества в растворе. Рт — давление газовой дыхательной смеси. Иначе говоря, в случае растворения смеси газов в жидкости в математическое выражение закона Генри (8.1) вместо р (X) подставляют парциальное давление р, данного компонента. Изучая растворимость… Читать ещё >
Растворимость газов в жидкостях. Законы Генри, Дальтона и Сеченова (реферат, курсовая, диплом, контрольная)
Растворение газов в жидкостях почти всегда сопровождается выделением теплоты (энтальпия ДЯраств.
Иногда растворение газа сопровождается поглощением теплоты, например растворение благородных газов в некоторых органических растворителях. В этом случае повышение температуры увеличивает растворимость газа.
Газ, как и многие другие вещества, не растворяется в жидкости беспредельно. 11ри некоторой концентрации газа X устанавливается равновесие:
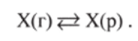
11ри растворении газа в жидкости происходит значительное уменьшение объема системы. Поэтому повышение давления, согласно принципу Ле Шателье, должно приводить к смещению равновесия вправо, т. е. к увеличению растворимости газа. Если газ малорастворим в данной жидкости и давление невелико, то растворимость газа пропорциональна его давлению. Эта зависимость выражается законом Генри (1803):
Количество газа, растворенного при данной температуре в определенном объеме жидкости, при равновесии прямо пропорционально давлению газа.
Закон Генри может быть записан в следующей форме:

где с (X) — концентрация газа в насыщенном растворе, моль/л; р (X) — давление газа X над раствором, Па; Яг (X) — постоянная Генри для газа X, моль-л '• Па 1 .
Константа Генри зависит от природы газа, растворителя и температуры. В табл. 8.3 представлены константы Генри для некоторых газов, растворенных в воде, при 298 К.
Закон Генри справедлив лишь для сравнительно разбавленных растворов, при невысоких давлениях и отсутствии химического взаимодействия между молекулами растворяемого газа и растворителя. Так, СО2 и NH3 вступают в химическое взаимодействие с водой, а, НО диссоциирует в воде, что резко повышает растворимость этих газов. При очень высоких давлениях растворимость газа может достигнуть максимума, поскольку в этом случае изменение объема жидкости вследствие растворения в ней газа становится соизмеримым с объемом растворенного газа.
Таблица 8.3
Константы Генри для газов, растворенных в воде (298 К).
Газ | А|(Х). моль-л'1нИа'1 | Газ. | А|(Х), моль-л'-нИа'1 |
м2 | 6,13 | н2 | 7,53 |
о2 | 12,8. | Нс | 3.73 |
со2 | Аг. | 14,9 |
Закон Генри является частным случаем общего закона Дальтона. Если речь идет о растворении не одного газообразного вещества, а смеси газов, то растворимость каждого компонента подчиняется закону Дальтона:
Растворимость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциальному давлению компонента над жидкостью и не зависит от общего давления смеси и индивидуальных свойств других компонентов.
Иначе говоря, в случае растворения смеси газов в жидкости в математическое выражение закона Генри (8.1) вместо р (X) подставляют парциальное давление р, данного компонента.
Под парциальным давлением р, компонента понимают часть общего давления Ровш газовой смеси, которая обусловлена этим компонентом:

Пример. Воздух представляет собой смесь, состоящую в основном из трех газов: 78% азота, 21% кислорода и 1% аргона (по объему). Определите концентрацию азота в воде при 298 К, если постоянная Генри равна 6,13* 10 4 моль-л '-Па .
Так как воздух содержит 78% азота по объему, парциальное давление азота в воздухе при 101 325 Па составляет 79 033,5 Па (объемная доля азота равна молярной доле азота, отсюда р (Ыг) =А>бщО, 78). Из закона Дальтона следует, что c (N2) = *KN2) * Р (М2), отсюда c (N2) = 6,13−10~9-79 033,5 = 4,84−10^ моль/л.
Изучая растворимость газов в жидкостях в присутствии электролитов, русский врач-физиолог И. М. Сеченов (1829−1905) установил следующую закономерность (закон Сеченова):
Растворимость газов в жидкостях в присутствии электролитов понижается; происходит высаливание газов.
Математическое выражение закона Сеченова имеет следующий вид:

где с (Х) — растворимость газа X в присутствии электролита; со (X) — растворимость газа X в чистом растворителе; сэ — концентрация электролита; Кс — константа Сеченова, зависящая от природы газа, электролита и температуры.
Одной из причин, приводящей к уменьшению растворимости газов в присутствии электролитов, является гидратация (сольватация) ионов электролитов молекулами растворителя. В результате этого процесса уменьшается число свободных молекул растворителя, а следовательно, понижается ею растворяющая способность.

Рис. 8.2. Роль закона Генри в жизнедеятельности:
а — растворение газа в жидкости. б — растворение газа в крови; р (Х|) — парцнальнос давление вещества Х| в газе, с (Х|) — концентрация ттого вещества в растворе. Рт — давление газовой дыхательной смеси.