Газообразное состояние вещества
Законы идеального газа можно рассматривать как частный случай данного уравнения (когда z = 1). Анализ экспериментальных данных показывает, что при достаточно высокой температуре z непрерывно возрастает с давлением, а при достаточно низкой температуре проходит через минимум. Последнее обусловлено тем, что взаимное притяжение приводит к уменьшению объема — большему, чем увеличение давления; но при… Читать ещё >
Газообразное состояние вещества (реферат, курсовая, диплом, контрольная)
Газ заполняет занимаемое им пространство равномерно. Он состоит из частиц, перемещающихся прямолинейно в отведенном ему объеме от одного до другого столкновения с иной частицей или со стенками сосуда. Удары частиц газа о стенки сосуда в сумме представляют собой силу, действующую на эти стенки. Отношение этой силы к величине поверхности стенок, т. е. сила, действующая на единицу поверхности, называется давлением газа на стенки сосуда.
Расстояние между частицами вещества в газообразном состоянии значительно превышает их размеры. Следовательно, во-первых, суммарный объем частиц газа по сравнению с емкостью занимаемого ими сосуда очень мал; во-вторых, силы взаимодействия между частицами в газе незначительны.
Очевидно, что при давлении, стремящемся к нулю (р —" 0), и объеме, занимаемом газом, стремящемся к бесконечности (V —> °°), взаимодействие между частицами в газе будет пренебрежимо мало. Такое воображаемое состояние вещества называется идеальным газом.
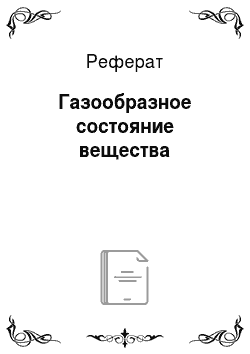
Для идеального газа взаимосвязь между давлением, температурой и объемом данного количества вещества описывается уравнением Клапейрона — Менделеева:
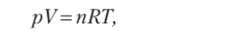
где р — давление газа, кПа; V — объем, занимаемый п молями данного газа, л; R — универсальная газовая постоянная, равная 8,314 Дж/К моль; Т — абсолютная температура, К.
Уравнению Клапейрона — Менделеева можно придать и следующий вид:
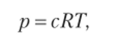
где с = п / V — концентрация газа, выражаемая в единице объема (моль/л).
В случае смеси газов указанное уравнение применимо к каждому газу:
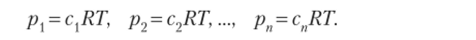
Общее давление смеси газов будет выражаться суммой давлений каждого газа:
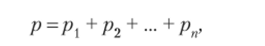
где pvp2, —>Рп — парциальные (индивидуальные) давления составляющих смесь газов.
Парциальное давление — это давление, которое производил бы каждый газ смеси, если бы он, находясь в том же количестве и при той же температуре, занимал один весь общий объем (закон Дж. Дальтона, 1803 г.). Таким образом, общее давление смеси газов равно сумме парциальных давлений. Другой вариант формулировки закона Дальтона: парциальное давленые газа в смеси равно его мольной доле, умноженной на общее давление.
Для определения скорости молекул газа используют выводы кинетической теории газов, основы которой были заложены в XVIII в. работами М. В. Ломоносова и Д. Бернулли. Согласно этой теории давление р, которое оказывает газ на стенки сосуда, зависит от силы удара его частиц. В свою очередь сила удара зависит от кинетической энергии (?кин) частиц, заключенных в данном объеме (V) газа:
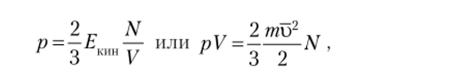
где N — число частиц в данном объеме V; т — масса частицы; и — среднеквадратичная скорость частиц, равная.
yj (v2i+vj + … + vl):N.
Для 1 моля газа можно записать:
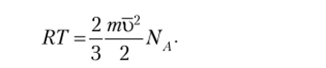
Заменяя произведение mNA на молярную массу газа М, получим:

Следовательно, среднеквадратичная скорость частиц газа прямо пропорциональна корню квадратному из абсолютной температуры и обратно пропорциональна корню квадратному из их молярной массы.
При 293 К и 101,325 кПа среднеквадратичная скорость молекул Н" составляет 1757 м/с, NH3—603 м/с, 02—441 м/с, НС1 — 412 м/с, С02—376 м/с и г. д. Однако скорости отдельных молекул значительно различаются. Распределение молекул газа по скоростям называется распределением Максвелла — Больцмана. Оно зависит как от типа тазов (рис. 4.1), так и от температуры (рис. 4.2).
Подобно распределению по скоростям существует распределение Максвелла — Больцмана, но энергиям частиц.
Вследствие непрерывного движения молекулы газа стремятся распространиться по всему объему. Этот процесс называется диффузией. Согласно закону Т. Грэхема скорость диффузии молекул газа (иГ[) через пористую перегородку обратно пропорциональна корню квадратному из плотности газа ид ~^1/р. Соответственно соотношение скоростей диффузии двух газов определяется соотношением их плотностей или молярных масс:
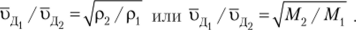
Для молекул.
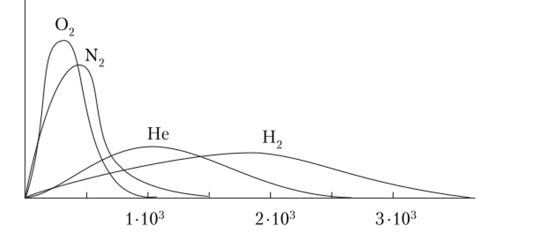
Рис. 4.1. Распределение молекул по скоростям Максвелла — Больцмана при температуре 298 К.
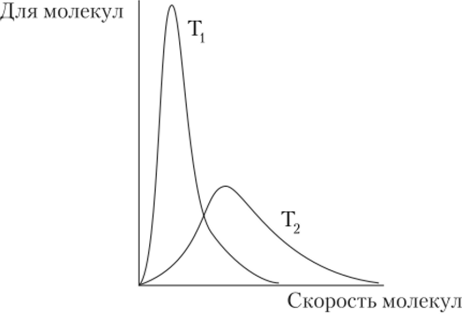
Рис. 4.2. Влияние температуры на распределение молекул по скоростям (Т2 > Т,).
Однако поведение реальных газов сходно с поведением идеальных газов лишь при очень низком давлении или высокой температуре. Это объясняется тем, что газовыми законами не учитываются взаимодействие между отдельными молекулами газа и их собственный объем.
Законы идеальных газов наиболее применимы к газам, которые трудно сжижаются (водород, гелий, неон). При условиях, близких к нормальным, эти законы довольно хорошо описывают поведение и таких газов, как азот, кислород, аргон, оксид углерода (П), метан, температуры кипения которых не особенно отличаются от температуры кипения воздуха. Значение величины pVдля этих газов отклоняются от значения RT не более чем на 5% даже при повышении давления до 5 МПа. Для легко сжижаемых газов — оксида углерода (1У), аммиака, хлора, оксида серы (1У), пропилена и др. — уже при атмосферном давлении реальное значение pV отличается от теоретического на 2—3%. Эти отклонения растут с увеличением давления (рис. 4.3) и понижением температуры.
Поэтому в уравнение состояния идеального газа вводятся две поправки: одна из них (/;) учитывает объем частиц (и их взаимное отталкивание при малых расстояниях), а другая — взаимное притяжение частиц (внутреннее давление рш1), приводящее к тому, что давление реальных газов ниже, чем давление идеального газа. Обе поправки зависят от природы данного газа. Таким образом, уравнение состояния реального газа может быть представлено в следующем виде:
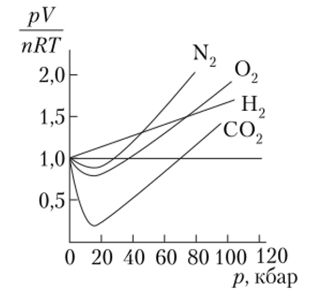
Рис. 4.3. Отклонение свойств реальных газов.
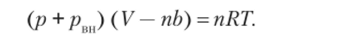
Можно считать, что поправка рш пропорциональна квадрату плотности газа, т. е. обратно пропорциональна объему. Отсюда приведенное выше уравнение принимает вид от свойств идеальных газов 
(при 273 К) Это уравнение получило наименование уравнения Я.Д. Ван-дер-Ваалъса, предложившего его в 1873 г. Постоянные а и b называются постоянными Ван-дер-Ваалъса. Их величины для некоторых газов приведены в табл. 4.2.
Таблица 4.2
Постоянные Ван-дер-Ваальса для некоторых газов
Газ. | а, л2кПа/моль2 | ь, л/моль. | Газ. | а,. л2к11а/моль2 | Ъ, л/моль. |
н2 | 24,9. | 0,0266. | n2 | 140,8. | 0,0391. |
Ne. | 21,4. | 0,0171. | СН4 | 227,9. | 0,0428. |
Аг. | 32,6. | 0,0322. | со2 | 363,7. | 0,0427. |
Хс. | 42,4. | 0,0510. | С12 | 657,4. | 0,0562. |
о2 | 137,8. | 0,3180. | са4 | 2066,0. | 0,1383. |
Сравнение данных табл. 4.2 показывает, что постоянная а растет с увеличением энергии вандерваальсовского взаимодействия, а постоянная b растет с увеличением размера молекул газа.
Однако константы а и /; в действительности зависят не только от природы вещества, но и от температуры и плотности газа, т. е. уравнение Ван-дер-Ваальса является приближенным и лишь качественно передает характер отличия реального газа от идеального. Иными словами, уравнение Ван-дер-Ваальса не приводит к количественному согласованию теоретических и экспериментальных результатов, однако оно, во-первых, дает представление о поведении газов, плотность которых не очень велика, а во-вторых, дает качественную картину явлений конденсации, а также критического состояния веществ (см. раздел диаграммы фазового состояния веществ). Отклонения от уравнения Ван-дер-Ваальса, зависящие при прочих равных условиях от природы газов, более значительны для сильно полярных веществу чем для неполярных.
Предложено множество уравнений состояния более точных, чем уравнение Ван-дер-Ваальса. Часть из них основана на его уточнении, другие получены иным путем. Их обилие свидетельствует о сложности проблемы получения уравнения состояния реального газа и о том, что ни одно из этих уравнений не является универсальным, т. е. не позволяет строго количественно определить /;-И-Г-зависимость в любых условиях для любых газов.
Аналогично следует рассуждать и относительно смеси газов. Закон Дж. Дальтона для нее не применим — введение новых частиц в сосуд, наполненный данным газом, может существенно повлиять на взаимодействие различных частиц и тем самым на давление, которое они оказывают.
Часто на практике полезно применять уравнение состояния в виде 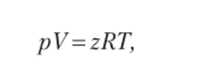
где г — коэффициент сжимаемости; безразмерный параметр, который зависит от температуры, давления и вида газа.
Законы идеального газа можно рассматривать как частный случай данного уравнения (когда z = 1). Анализ экспериментальных данных показывает, что при достаточно высокой температуре z непрерывно возрастает с давлением, а при достаточно низкой температуре проходит через минимум. Последнее обусловлено тем, что взаимное притяжение приводит к уменьшению объема — большему, чем увеличение давления; но при значительном сближении частиц начинает сказываться влияние собственного объема частиц и тогда уменьшение V проявляется меньше, чем у идеального газа.
Высокие давления изменяют структуру вещества в том же направлении, что и низкие температуры. При этом объем газа сильно уменьшается, во столько же раз возрастает его плотность, и по своей внутренней структуре газ становится более похож на жидкость. Смешиваемость газов между собой ограничивается, появляется способность к растворению многих веществ. Кроме того, некоторые газы способны переходить в газокристаллическое состояние, в котором их молекулы располагаются относительно друг друга в определенном порядке, «упаковываясь» в кристаллические структуры, но не вследствие большого взаимодействия между ними (как в твердом веществе), а из-за недостатка свободного пространства. Например, гелий, оксид углерода (ТУ), хлорид фосфония (РН4С1) при очень высоких давлениях переходят в указанное выше состояние. Оказалось также, что при высоких давлениях вещества могут переходить в твердое состояние без промежуточного перехода в жидкое состояние, как, например, оксид углерода (1У).