Неполярная и полярная ковалентная связь

Если молекула образована атомами с различной электро— отрицательностью и сродством к электрону, то электронная плотность связи смещена в сторону атома, обладающего большей электроотрицательностыоf и ковалентная связь является полярной (Н~8 —" СГ8, Н~8 —> 18 и т. д.). Стрелкой показывается направление смещения химической связи к более электроотрицательному атому, а символ 5 (греч. дельта… Читать ещё >
Неполярная и полярная ковалентная связь (реферат, курсовая, диплом, контрольная)
Если молекула образована одинаковыми атомами, то электронная плотность химической связи расположена между ними симметрично и ковалентная связь неполярна (Н — Н, Cl — Cl и та).
Если молекула образована атомами с различной электро— отрицательностью и сродством к электрону, то электронная плотность связи смещена в сторону атома, обладающего большей электроотрицательностыоf и ковалентная связь является полярной (Н~8 —" СГ8, Н~8 —> 18 и т. д.). Стрелкой показывается направление смещения химической связи к более электроотрицательному атому, а символ 5 (греч. дельта) обозначает величину частичных (эффективных) зарядов, возникающих на атомах за счет такого смещения. Этот энергетический эффект называют индукционным или индуктивным эффектом. Вследствие этого возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися на определенном расстоянии (длина диполя) друг от друга. Количественной мерой полярности молекулы является электрический момент диполя (р), который равен произведению абсолютной величины эффективного заряда (8) на длину диполя (/):
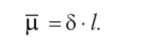
Электрические моменты диполя молекул измеряют в кулонах на метр (Кл • м) или в Дебаях (1 Д = 3,3 • 10~30 Кл • м). Молекула тем более полярна, чем выше эффективные заряды атомов и чем больше длина диполя, т.е. чем больше электрический момент диполя. Для многоатомных молекул при наличии нескольких полярных связей их электрические моменты диполей складываются как векторные величины по правилу параллелограмма. В молекуле С02 каждая связь С — О полярна, но дипольные моменты равны, но величине и направлены в противоположные стороны. Поэтому суммарный дипольный момент молекулы равен нулю. Молекулы S02, Н20, H2S имеют угловое строение. Например, полярные ковалентные связи в молекуле воды располагаются под углом 104,5°, взаимно не компенсируя электрический момент диполя (1,85 Д). У S02 р =1,63 Д; у H2S р = 0,97 Д. Отметим, что полярная ковалентная связь является наиболее распространенным типом химической связи.
Величину наведенного (эффективного) заряда на взаимодействующих атомах как долю (%) от заряда электрона можно рассчитать по следующей формуле:

где р и рион — электрические моменты диполей, найденные у молекулы экспериментально и рассчитанные исходя из предположения о полном переходе обобществленной электронной пары к одному из атомов.
Например, для молекулы НС1 расчет по данной формуле показывает, что эффективный заряд на атомах водорода и хлора, образующих полярную связь, составляет 17% от заряда электрона. Полученное значение, таким образом, характеризует степень ионности связи, которая, в свою очередь, определяется разностью электроотрицательностей (ДЭО) атомов, участвующих в образовании связи.