Хемолитоавтотрофия (окисление восстановленных неорганических соединений для получения энергии)

Окисление неорганических соединений для получения энергии, сопряженное с построением клеточного материала из С02, свойственно только прокариотам. Такой modus vivendi носит название хемолитоавтотрофии. Процесс хемолитоавтотрофии был открыт в 1887 г. С. Н. Виноградским, работавшим в ту пору в Страсбурге в лаборатории А. де Бари. Исследуя метаболизм бесцветной нитчатой серобактерии из рода… Читать ещё >
Хемолитоавтотрофия (окисление восстановленных неорганических соединений для получения энергии) (реферат, курсовая, диплом, контрольная)
Окисление неорганических соединений для получения энергии, сопряженное с построением клеточного материала из С02, свойственно только прокариотам. Такой modus vivendi носит название хемолитоавтотрофии. Процесс хемолитоавтотрофии был открыт в 1887 г. С. Н. Виноградским, работавшим в ту пору в Страсбурге в лаборатории А. де Бари. Исследуя метаболизм бесцветной нитчатой серобактерии из рода Beggiatoa, растущей на поверхности донных осадков в застойных водоемах, ученый заметил, что клетки росли и размножались, окисляя H2S и откладывая элементарную серу в цитоплазме. При исчерпании сероводорода микроорганизмы окисляли отложенную серу до сульфата. В 1983 г. было показано, что штамм, с которым работал С. Н. Виноградский, требует небольших количеств органических соединений для роста, т. е. является факультативным автотрофом. Значительно позднее из морских местообитаний в зоне «черных курильщиков» были выделены облигатно автотрофные виды Beggiatoa. Там они обеспечивают первичную продукцию органического вещества за счет хемолитоавтогрофии. Также тионовые бактерии участвуют в образовании микробных матов толщиной до 60 см и диаметром до 32 м, где толстые и длинные клетки Beggiatoa служат структурообразующим элементом.
В настоящее время известно значительное число тионовых микроорганизмов, способных окислять восстановленные соединения серы. Эти микроорганизмы принимают участие в глобальном цикле серы. Сероводород образуется в природе повсеместно в процессе аммонификации и по достижении аэробной зоны окисляется тионовыми микроорганизмами. Таким образом, тионовые микроорганизмы являются бактериальным газовым фильтром для H2S, не позволяющим ему попадать в значительных количествах в атмосферу. В районах с вулканической активностью имеются природные выходы серы на поверхности Земли (сольфатары).
Тионовые микроорганизмы являются, в основном, аэробами. Короткий период они могут существовать без кислорода, окисляя сероводород в процессе нитратного дыхания, но при наличии подвижности активно покидают анаэробные местообитания.
Традиционно организмы, окисляющие восстановленные соединения серы, делят на две группы: I группа окисляет сероводород и откладывает элементарную серу в виде капель внутри клеток, а II группа никогда серу внутри клеток не откладывает. К I группе относятся морфологически своеобразные микроорганизмы. Это представители родов Beggiatoa, Thiothrix, Macromonas, Bilophococcus, ThiopIocay Thiospirillopsis, Achromatium, Thiobacterium, Thiospiray Thiovulvum. Только для некоторых представителей четко установлен тип метаболизма, поскольку лишь в первых четырех родах из списка получены чистые культуры. Выделение чистых культур бактерий I группы затруднено из-за присутствия в их слизистых чехлах многочисленных микробов-спутников. В эту группу входят грамотрицательные бесцветные клетки разной морфологии (крупные кокки и овалы, мелкие спирали, нити и длинные палочки), растущие на средах с H2S и откладывающие серу в клетках. Некоторые движутся с помощью скольжения или жгутиков, Achromatium и Thiobactenum — неподвижны. Большинство образует мощные капсулы или чехлы. Они обычно растут на границе аэробной и анаэробной зон (в зоне хемоклина стратифицированных озер) в условиях микроаэрофилии, образуя налет на донных осадках. Оптимальная концентрация кислорода для их роста составляет 0,6—6%. Для тионовых бактерий I группы характерен отрицательный светои аэротаксис, некоторые имеют магнитосомы. Считается, что тионовые бактерии — гетеротрофы или миксотрофы, склонные к олиготрофии. Предельная концентрация органических кислот для роста бесцветных нитчатых серных бактерий — 20 мМ (для ацетата это 1,2 г/л).
II группа тионовых микроорганизмов — это одиночные небольшие палочковидные клетки, относящиеся к наиболее изученным родам Thiobacillus, Acidithiobacillus у Sulfobacillus, а также археи родов Sulfolobus и Acidianus. Они никогда не откладывают элементарную серу в клетках и проводят процесс до образования сульфата. Первые тиобациллы были выделены А. Натансоном в 1902 г., а в 1904 г. М. Бейеринк показал, что Thiobacillus thioparus и Т. thiooxidans (в настоящее время относимая к роду Acidithiobacillus) используют в своем метаболизме сероводород.
Микроорганизмы этих родов различаются по отношению к pH: тиобациллы растут при слабокислых значениях pH, а ацидитиобациллы и сульфобациллы — при pH < 4,0 (до 1,5). Большинство представителей этой группы — мезофилы. Они широко распространены и обитают в почвах, соленых болотах, в зоне термоклина стратифицированных озер, в сольфатарах, там, где на выходе горячих серных источников на поверхности образуются желтые осадки элементарной серы, в сточных водах, в кислых шахтных водах (pH 2,5—1,5). Наличие в щелочных почвах тиобацилл иногда используют для «исправления» pH: в почвы вносят порошок серы, и образующийся при ее окислении SO4- подкисляет почву. При температуре выше 50 °C серу окисляют археи (Sulfolobus, Acidianus) или представители рода Sulfobacillus.
Реакции окисления восстановленных соединений серы характеризуются разными значениями свободной энергии:
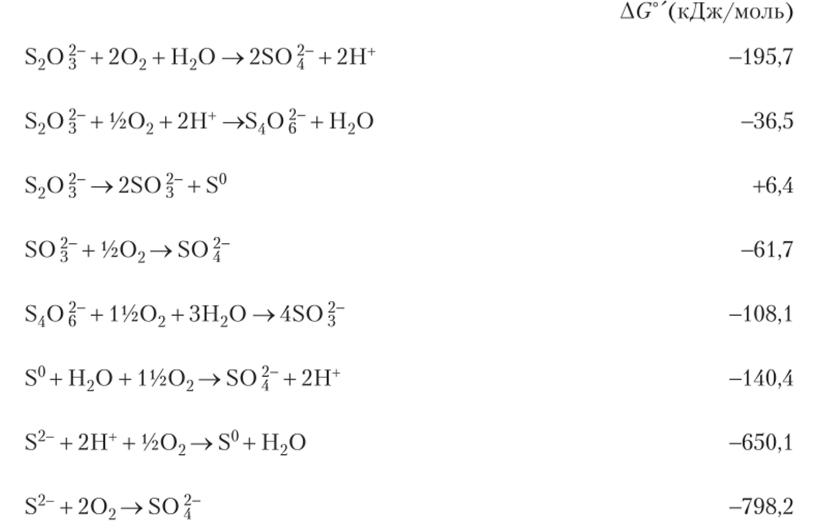
Электроны попадают в ЭТИ, тионовых бактерий на уровне цитохромов (рис. 7.35), поэтому для синтеза восстановительных эквивалентов приходится затрачивать энергию для синтеза восстановительных эквивалентов путем обратного переноса электронов.
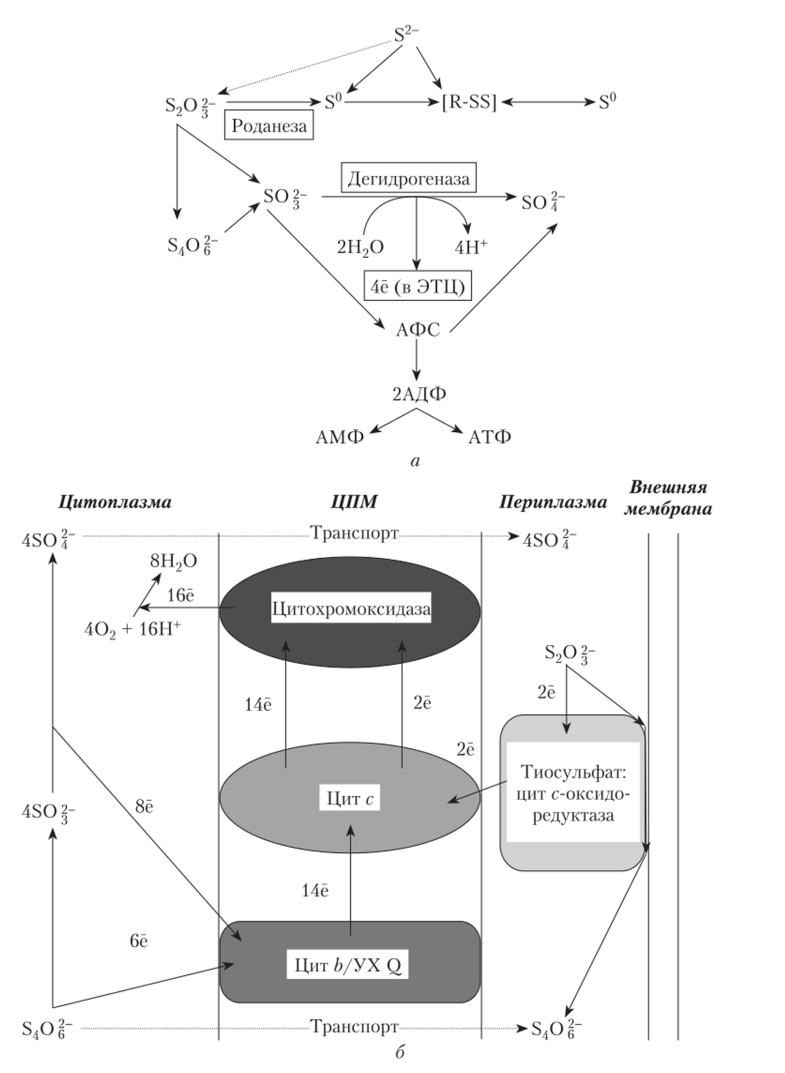
Рис. 7.35. Использование соединений серы тионовыми микроорганизмами:
а — схема превращений соединений серы; R-SS — мембрансвязанный полисульфид; АФС — аденозинфосфосульфат; б — организация ЭТЦ некоторых гиобацилл В 1987 г. было показано, что у Desulfovibrio и Desulfobacter может идти реакция диспропорционирования тиосульфата:
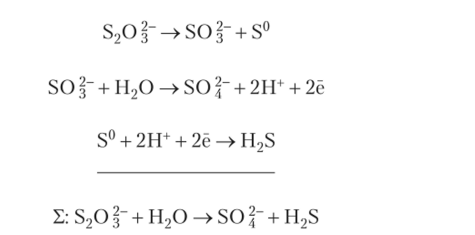
Автотрофная ассимиляция С02 у тионовых микроорганизмов происходит через цикл Кальвина. В клетках формируются окруженные простой белковой мембраной карбоксисомы, в которых содержится ключевой фермент этого цикла — рибулозобисфосфаткарбоксилаза-оксигеназа (РубисКО, RubisCO). При переходе к ассимиляции органических веществ карбоксисомы в клетках не обнаруживается.
В том же году установили наличие такой реакции:

Металлокисляющие микроорганизмы — это еще одна группа хемолитоавтотрофов, среди которых наиболее изучены железоокисляющие организмы, окисляющие Fe2+ до Fe3+. Большой вклад в их исследование внесли С. Н. Виноградский и М. Бейеринк.
Такие микроорганизмы легко обнаруживаются в природных водоемах в виде обрастаний нижней части водных растений. Большинство из них растет при средних температурах в аэробных условиях, экстремальные термофилы встречаются только среди архей. При pH < 5,0 Fe2+ стабилен, поэтому в таких природных местообитаниях преимущественно развиваются ацидофильные железоокислители (например, бактерии рода Leptothrix и Acidithiobacillus). Они, как правило, заключены в слизистые чехлы, которые постепенно инкрустируются гидроксидом железа (III). Лишь некоторые представители железоокислителей (например, Galionella ferruginea, выделенная X. Г. Эренбергом в 1836 г.) растут в нейтральных средах. Поскольку при pH = 7,0 в аэробных условиях Fe2+ нестабилен, то галионеллы обитают на выходе подземных ключей, где концентрация кислорода очень низкая. G. ferruginea имеет фасолевидные клетки, прикрепляющиеся к поверхности с помощью слизистой скрученной ножки, инкрустированной Fe (OII)3.
Fe-оксидоредуктаза, содержащая в качестве кофактора рустицианин с ОВП + 680 мВ, передает электроны на цитохром аа3, поэтому ЭТЦ получается короткой с одним пунктом сопряжения. Окисление Fe2+ до Fe3+ дает мало энергии (при pH = 2,0 OBnFe3+/Fe2+ = +650 мВ), и для поддержания роста микроорганизму необходимо переработать большое количество двухвалентного железа. Подсчитано, что для фиксации 48 г С02 требуется окислить 2,8 кг Fe2+. Предполагают, что в природных условиях может происходить процесс одновременного окисления железа и сульфида в составе н ерастворим ых мин ерал о в:
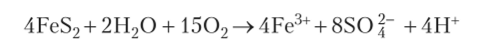
Выделены микроорганизмы, способные окислять другие металлы, например, Мп2+, устойчивый при щелочных pH, до Мп4+. Окисление марганца термодинамически выгодно в интервале pH от 6 до 8, поэтому такие микроорганизмы растут в этом диапазоне кислотности среды. С понижением pH оно становится менее выгодным, а для окисления железа зависимость обратная. Микроорганизмы, способные окислять и железо, и марганец, обладают устойчивым ростом в широком диапазоне значений pH:
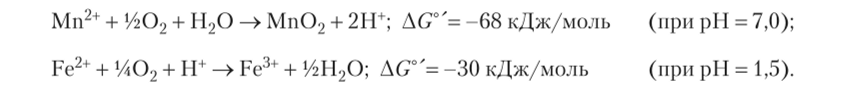
Некоторые металлокисляющие микроорганизмы представлены в табл. 7.4.
Таблица 7.4
Микроорганизмы, окисляющие металлы.
Микроорганизм. | Неорганический субстрат. | Форма клеток. | Место обитания. |
Бактерии-автотрофы. | |||
Galionella ferruginea | Fc2+ | Изогнутые фасолевидные палочки с закругленными концами. | Пресная вода. |
Leptospirillum fenuginea | Fe2+ | Изогнутые и спиральные палочки. | Кислые шахтные воды. |
Stibiobacter senarmontii | Sb3+ | Плейоморфные палочки. | Пресные воды. |
A cidithiobacillus fetrooxidans | Fe2+, S°, Se°, U4+ | Палочки. | Кислые шахтные воды. |
Бактерии-гетеротрофы. | |||
Arthrobacter sp. | Mn2+ | Плейоморфные палочки. | Почва. |
Окончание табл. 7.4
Микроорганизм. | Неорганический субстрат. | Форма клеток. | Место обитания. |
Bacillus megaterium | Se°. | Палочки. | Почва. |
Bacillus sp. | Mn2t | Палочки. | Пресные воды. |
Citrohacter sp. | Mn2*. | Палочки. | Почва. |
Hyphomicrobium sp. | Mn2*. | Почкующиеся палочки. | Пресные и морские воды. |
Leptothrix discophora | Fe2+, Mn2*. | Искривленные палочки. | Пресные воды. |
Oceanospirillum sp. | Mn2*. | Искривленные и спиральные палочки. | Морские воды. |
Pedomicrobium sp. | Mn2*. | Почкующиеся палочки. | Почва. |
Pseudomonas sp. S-36. | Mn2*. | Палочки. | Пресные воды. |
Vibrio sp. | Mn2*. | Искривленные палочки. | Морские воды. |
Археи-автотрофы. | |||
Sulfolobus addocaldarius | Mn2*, S°, Fc2*. | Лопастные и кокковидные клетки. | Горячие источники. |
Среди бактерий к автотрофии за ечет окисления железа способны представители родов Galionella, Leptospirillum, Acidithiobacillus. Последние могут также окислять элементную серу, селен и уран. К автотрофному окислению сурьмы способен Stibiobacter senarmontii. Автотрофный архей Sulfolobus addocaldarius, выделенный из горячего источника, может использовать для получения энергии железо и марганец. Только для Sulfolobus addocaldarius доказана четкая автотрофия при окислении марганца, при этом С02 фиксируется в цикле Кальвина. Гетеротрофные металлоокислители распространены в почве, пресных и морских водоемах. Это представители родов Bacillus, Arthrobacter, Hyphomicrobium, Pedomicrobium, Pseudomonas, Vibrio и др. Бурное развитие железоокисляющих микроорганизмов рода Leptothrix
в водопроводных трубах приводит к их забиванию слизью и губчатой ржавчиной. Для местообитаний с низкой кислотностью среды (pH < 5,0) характерно присутствие Acidithiobacillus thiooxidans и A. ferrooxidans. Недавно установлен факт развития A. ferrooxidans за счет анаэробного дыхания с Fe3+ и S° в качестве конечных акцепторов электронов.
Установлено, что ряд микроорганизмов при окислении металлов не получает энергии, а просто откладывает их оксиды в своих слизистых чехлах. Например, так накапливает оксид марганца Crenothrix manganifera.
Окисление ряда металлов с переменной валентностью (Cu2+, U4+, As3+, Sb3+, Мо4+, Se°, Zn2+, Co2+, Pb2+, Ni2+, Au° и т. д.) показано для некоторых накопительных культур.
Микроорганизмы, способные окислять восстановленные соединения серы и металлы с переменной валентностью, применяют в биогидрометаллургии для получения (выщелачивания) металлов из бедных руд. Обычно используют природные микробные сообщества, содержащие представителей бактериальных родов Acidithiobacillus (A. ferrooxidans и A. thiooxidans), Leptospirillum, Sulfobacillus и архей родов Sulfolobus, Ferroplasma, Metallosphaera, Acidianus. Суспензия микроорганизмов, обогащенная кислородом, закачивается в пласт, либо ею орошают рудные отвалы. Посредством следующих реакций металл переводится в растворенное состояние:
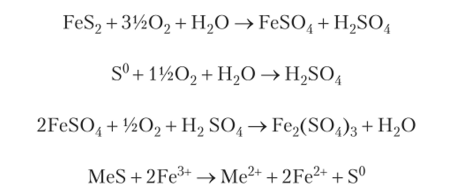
Полученный раствор откачивают из скважины или собирают у подножия кучи, концентрируют и осаждают из него металл. Участвующие в этом процессе микроорганизмы обладают устойчивостью к высоким концентрациям металлов. Микробиологические процессы используют при получении меди, урана, марганца, а также для освобождения олова, серебра и золота из нерастворимых сульфидных минералов, содержащих мышьяк.
Еще одной группой хемолитоавтотрофов являются нитрифицирующие микроорганизмы. Процесс превращения аммиака в нитрат использовался в Европе для получения селитры при изготовлении пороха задолго до того, как стала известна его микробная природа. Земляные валы поливали кровью животных со скотобоен, перекапывали для обогащения кислородом и вносили золу для нейтрализации и как источник калия. Белки крови разлагались под действием почвенных микроорганизмов с выделением аммиака, который окислялся нитрифицирующими бактериями до нитрата. При реакции нитрата с ионами калия образовывался выцвет селитры, который растворяли и выпаривали.
С. Н. Виноградский для выделения чистых культур нитрификаторов предложил метод «отрицательных пластинок»: сильно разведенные сусиензии высевались на агар или силикагель, и те кусочки агара, где не было роста гетеротрофов, переносили на среду с NH В его статье, появившейся в 1890 г., процесс нитрификации описывался как одностадийный (NHJ—> —" NO з). В том же году Дж. и Г. Франкланды опубликовали статью о выделении микроорганизма, который осуществляет реакцию NH J -> N0 2. Стало ясно, что нитрификация идет в две стадии, а супруги Франкланд выделили микроорганизмы I фазы. В 1949 г. С. Н. Виноградский исправил прежнюю статью, признав двустадийность процесса нитрификации (NHJ—> ^NOi->NOi).
Нитрифицирующие микроорганизмы — это грамотрицательные виды, объединенные по способности окислять аммиак, а не филогенетически. Они встречаются в классах Beta-, Gamma- и Epsilonproteobacteria филума Proteobacteria, а также в классе Nitrospira филума Nitrospirae. Названия родов нитрификаторов I фазы обычно начинаются с Nitroso-, а нитрификаторов II фазы — с Nit.ro-. Микроорганизмы I (NH3 —> М02) и II (N02 —" —"N03) стадий нитрификации в природе всегда живут вместе, и токсичный нитрит, образованный бактериями I стадии, быстро потребляется нитрификаторами II фазы и не накапливается выше, чем НГ1 М. Клетки различной формы (палочковидные, изогнутые, спиральные, кокковидные) могут быть подвижными в молодом возрасте, а при старении формируют биопленки. Нитрификаторы имеют в разной степени развитые внутриклеточные разрастания ЦПМ. У Nitrosomonas они параллельны мембране клетки, у Nitrosococcus образуют стопки ламелл, у Nitrosolobus формируют инвагинации.
Для фиксации С02 нитрификаторы используют цикл Кальвина, в котором затрачивается большое количество АТФ и восстановительных эквивалентов. При автотрофном росте в клетках образуются карбоксисомы с РубисКО. Процесс образования карбоксисом для бактерий II фазы более редок, чем для микроорганизмов I фазы. Все нитрификаторы 11 фазы способны также к миксотрофному росту. Некоторые представители рода Nitrobacter могут расти гетеротрофно, используя органические вещества (ацетат, казеин, пируват и т. д.), но преимуществ в росте при этом не получают.
При окислении аммиака и нитрита электроны поступают в ЭТЦ на уровне цитохромов, и энергии запасается мало, так как имеется только один пункт сопряжения (рис. 7.36). На I стадии аммиак проникает в клетки и окисляется монооксигеназой до гидроксиламина: NH3 + V2O2 —> NH2OH. Эта реакция идет с затратой энергии в виде восстановителя. При окислении гидроксиламина периплазматической гидроксиламиноксидоредуктазой образуется нитрит (N112OII + Н20 —> IIN02 + 4Н+ + 4с). При этом электроны переносятся на уровень цитохромов b и с. Гидроксиламиноксидоредуктаза — эго фермент с молекулярной массой ~ 200 кДа, имеющий структуру а3Р3 и находящийся в периплазме. С активностью этого фермента связаны также активности монооксигеназы аммиака и цитохромоксидазы. В то же время клетки на среде с чистым гидроксиламином вырастить не удается (без аммиака гидроксиламин целыми клетками не окисляется).

Рис. 736. Схема ЭТЦ окисления субстратов нитрификаторами I фазы:
МО — монооксигеназа; ГАОР — гидроксиламиноксидоредуктаза Для образования восстановленных пиридиннуклеотидов у нитрификаторов I фазы задействован обратный перенос электронов с затратой энергии. Именно поэтому они растут довольно медленно (время генерации составляет около 24 ч) и накапливают мало биомассы.
II стадия нитрификации приводит к окислению нитрита в нитрат с участием мембрансвязанного фермента нитритоксидоредуктазы: N0 2 + Н20 —".
—" NO3 + 2H+ + 2ё и 2Н+ + 2ё + !/Ю2 —" Н20. Подсчитано, что при окислении 14,5 моля NO2 в NO3 образуется 4 • 1()7 клеток Nitrobacter, а время генерации составляет от 10 до 100 ч. Пара нитрит/нитрат имеет ОВП = = +400 мВ, и электроны переносятся на уровень цитохромоксидазы, поэтому в результате генерируется только одна молекула ЛТФ (имеется один пункт сопряжения). Подсчитано, что на образование 1 моля НАДН путем обратного переноса электронов необходимо затратить 5 молей нитрита, а для фиксации 1 г С02 нужно окислить 35 г N02". В то же время установлено, что клетки рода Nitrobacter используют только 2—10% энергии, заключенной в NO^.
Нитрификаторы обычно растут в аэробных (или микроаэрофильных) зонах с нейтральным pH (оптимум pH 7,5) и средними температурами (оптимум 28—30°С). При низком pH (< 5,0) нитрит диспропорционирует на нитрат и оксид азота. Нитрификаторы чувствительны к повышенной концентрации нитрата и кислорода.
В настоящее время доказана способность к нитрификации у архей, объединенных в новый филум Thaumarchaeota и обитающих преимущественно в океанах в аэробных и микроаэрофильных зонах. В конце 2015 г. в журнале «Nature» была опубликована статья об обнаружении бактерий рода Nitrospira, которые осуществляют самостоятельно полную нитрификацию аммония в нитрат, т. е. один микроорганизм проводит обе стадии процесса, названного комаммокс (сотаттох — complete ammonia oxidation). Оказалось, что полная нитрификация — это энергетически выгодный процесс, а комаммокс-бактерии широко распространены в природных местообитаниях. Открытие комаммокс-процесса привело к ревизии схемы глобального цикла азота и к добавлению еще одной «ветви» в его окислительную часть (см. Т. 2, рис. 14.3).
Ранее считали, что нитрификация — это сугубо аэробный процесс. Однако в анаэробных реакторах, осуществляющих очистку стоков от соединений азота, было показано, что аммоний окисляется в присутствии нитрита в соответствии с реакцией 15NH| + 14N02—" l4,15N2T + Н20, наличие которой было доказано с помощью меченых соединений. Процесс получил название анаммокс (апаттох — anaerobic ammonia oxidation). Анаэробное окисление аммония осуществляют особые бактерии-планктомицеты, входящие в филум Planctomycetes. Клетки анаммокс-бактерий имеют кокковидную или нерегулярно изрезанную форму диаметром около 1 мкм. В их клеточной стенке не обнаружено пептидогикана, но имеется S-слой. Клетки анаммокс-планктомицетов разделены на три компартмента, что необычно для прокариот. Под цитоплазматической мембраной лежит область толщиной 31—39 им, не содержащая РНК (парифоплазма) с пока неясными функциями. Под ней находится первая внутренняя мембрана, за которой лежит рибоплазма, типичная бактериальная цитоплазма, содержащая рибосомы, нуклеоид и часто гранулы гликогена. Ниже расположена анаммоксосома, отграниченная прочной непроницаемой двуслойной мембраной и занимающая 50—70% объема клетки. В этой структуре осуществляются катаболические реакции клетки, и она может считаться функциональным аналогом митохондрий эукариот. Мембрана анаммоксосомы для увеличения площади поверхности образует складки, с ней ассоциирована АТФ-аза и цитохромы с. Непроницаемая мембрана не позволяет токсичным интермедиатам анаммокс-процесса проникать в рибоплазму, а также поддерживает протонный градиент. Мембраны анаммокс-бактерий содержат уникальные ладдеральные липиды (от англ, ladder — лестница), состоящие из циклобутановых колец, расположенных в одной плоскости, придающих мембранам прочность и малую проницаемость.
Анаммокс-бактерии являются медленно растущими микроорганизмами (среднее время удвоения в лаборатории составляет 11 сут.). Они обычно существуют в виде сарциноподобных микроколоний, образующих агрегаты. Ни один представитель пока нс получен в виде чистой культуры, описанным анаммокс-планктомицетам присвоен статус Candidatus. В природных местообитаниях анаммокс-бактерии конкурируют с денитрификаторами. При наличии большого количества органических веществ денитрификаторы абсолютно доминируют из-за высокой скорости роста, но по мере исчерпания органического донора начинают преобладать анаммокс-бактерии, являющиеся хемолитотрофами. Недавно показана также функциональная связь анаммокси комаммокс-бактерий и присутствие их в одних и тех же агрегатах в условиях низкого содержания кислорода. Процесс окисления аммиака в анаэробных условиях всегда идет автотрофно.
Некоторые почвенные бактерии и плесневые грибы способны к гетеротрофному окислению аммиака (аммония). В этом случае ионы аммония окисляются до нитрата без запасания энергии. Такой процесс наносит вред сельскому хозяйству, поскольку приводит к вымыванию связанных форм азота из почвы вследствие перевода аммонийного азота в более растворимые нитратные формы.
Группа водородных микроорганизмов, способных к хемолитоавготрофии, окисляет молекулярный водород и ассимилирует С02. Н2 — очень энергоемкий субстрат, дающий до трех молекул АТФ при прохождении электронов по ЭТИ, (рис. 7.37).

Рис. 7.37. ЭТЦ водородных бактерий при росте в автотрофных условиях.
С этим субстратом работают ферменты гидрогеназы, которые бывают двух типов: поглощающая (у водородокисляющих микроорганизмов) и выделяющая (у микроорганизмов, образующих водород в процессе брожений, фототрофов и т. д.). У аэробных форм конечным акцептором электронов служит кислород. Эти микроорганизмы способны расти на очень простой среде, по сути дела осуществляя постепенную реакцию «гремучего газа». Среди анаэробов водородотрофные микроорганизмы распространены в группах метаногенов, гомоацетогенов, сульфатредукторов и пурпурных бактерий. Некоторые представители водородиспользующих микроорганизмов разных систематических и функциональных групп приведены в табл. 7.5.
Примеры водородных микроорганизмов.
Группа микроорганизмов. | Микроорганизм. | Путь фиксации C02 |
Автотрофы и миксотрофы. | Alcaligenes eutrophus | Цикл Кальвина. |
Aquaspirillum autotrophicum | ||
Arthrobacter sp. 11/x. | ||
Bradyrhizobium japonicum | ||
Paracoccus denitrificans | ||
Mycobacterium gordonae | ||
Hydrogenobacter thermophilus | Цикл Арнона. | |
Гомоацетогены. | A. woodii | Ацетил-КоА-путь. |
Acetogenium kivui | ||
Clostridium aceticum | ||
Метаногены. | Methanobrevibacter arboriphilus | |
Methanosarcina barkeri | ||
Сульфатредукторы. | Desulfobacter hydrogenophilus | |
Desulfobacterium autotrophicum |
Автотрофная ассимиляция углекислого газа у разных групп водородных микроорганизмов происходит различными способами. Метаногены, гомоацетогены и сульфатредукторы фиксируют С02 в ацетил-КоА-пути, у большинства аэробных бактерий обнаружен цикл Кальвина. Аэробные водородные бактерии, как правило, являются факультативными автотрофами, т. е. способны переключаться на потребление органических веществ. Так, Alcaligenes eutrophus может аэробно расти на средах с глюкозой. A. eutrophus обладает цитохромами а, Ь, с, причем высокие концентрации цит с обнаруживаются в периплазме. Этот микроорганизм имеет две плазмиды — большую и маленькую. Установлено, что некоторые компоненты гидрогеназ и ферментов цикла Кальвина закодированы в плазмидах. Этот микроорганизм имеет два типа поглощающей гидрогеиазы — растворимую и мембрансвязанную, содержащие в своем составе Ni2+. Первая поставляет восстановленные пиридиннуклеотиды в цикл Кальвина, вторая восстанавливает НАД+, окисляющийся в ЭТЦ. Регуляция этих ферментов осуществляется по типу репрессии-дерепрессии.
Другая водородная бактерия, облигатный автотроф Hydrogenobacter thermophilus, является типичным градиентным организмом, микроаэрофилом, растущим при 70 °C на среде с соотношением газов Н2: С02: 02, равным 75: 10: 15. При этом он имеет «анаэробный» цикл фиксации С02 (восстановительный ЦТК, модифицированный цикл Арнона). Углекислый газ фиксируется в реакциях карбоксилирования ацетил~КоА, пирувата, сукцинил~КоА и а-кетоглутарата. Модификации цикла Арнона у гидрогенобактера заключаются в том, что отсутствует ферредоксин в ЭТЦ, а пирувати а-кетоглутаратдегидрогеназы не зависят от пиридиннуклеотидов.
Еще одна водородная бактерия, азотфиксирующий микроорганизм Bradyrhizobium japonicum, имеет нитрогеназу, выделяющую Н2. Когда клетки растут в виде бактероидов в клубеньках, они синтезируют цит Р42о, цит с и флавопротеин-цитохромоксидазу, а в чистой культуре — цит а, при этом конечные звенья ЭТЦ разветвлены. При пониженном содержании кислорода (1—2%) наряду с нитрогеназным комплексом экспрессируется гидрогеназа, связанная с мембранами и содержащая Ni2+, и другие ферменты литотрофного метаболизма. Это дает микроорганизму определенное экологическое преимущество, поскольку молекулярный водород, являющийся «отходом» азотфиксации, может быть использован как дополнительный источник энергии.
Водородных бактерий применяют для синтеза микробного белка в качестве кормовой добавки. Молекулярный водород для этого процесса получают электролизом воды с затратой энергии гидроэлектростанций. Водородные микроорганизмы могут использоваться как поглотители углекислоты в замкнутых системах (на подводных лодках, космических кораблях и станциях). Данные микроорганизмы интересны и как источник природных полимеров. Такие вещества, получившие название природных термопластиков (самое известное и распространенное — поли-ргидроксимасляная кислота), синтезируются в качестве запасного продукта до 90% по массе при росте водородных бактерий на глюкозе и могут быть легко разрушены микроорганизмами. Если такое вещество использовать как сополимер при синтезе полиэтилена или полипропилена, широко применяемых в качестве упаковочных материалов, то их разложение в природе будет происходить значительно быстрее.
Карбоксидотрофные микроорганизмы как группа хемолитоавтотрофов похожи по метаболизму на водородных микроорганизмов. Часто эти активности присутствуют у одной культуры. Угарный газ (СО) может служить как акцептором электронов при карбонатном дыхании, так и донором электронов у карбоксидобакгерий. Если микроорганизмы используют СО как донор электронов, то акцептором могут быть: 02, S°, SO2-, NO3, Fe3+, С02.
Угарный газ появляется в природе, в основном, за счет деятельности человека, а также при горении лесов и извержении вулканов. В атмосфере он подвергается фотоокислению до С02.
Некоторые карбоксидотрофные микроорганизмы, входящие в разные аэробные и анаэробные функциональные группы, приведены в табл. 7.6.
Микроорганизмы, использующие в метаболизме СО.
Физиологическая группа. | Микроорганизмы. |
Типичные карбоксидотрофы-аэробы. | Acinetobacter sp. |
Alcaligenes carboxydus | |
Arthrobacter sp. | |
Bacillus schlegelii | |
Pseudomonas carboxydoflava | |
P. carboxydovorans | |
P. gazotropha | |
Азотфиксаторы. | Streptomyces thermoautotrophicus |
Azovorans sp. | |
Azospirillum lipoferum | |
Azotobacter sp. | |
Bradyrhizobium japonicum | |
Метанотрофы. | Methylomonas methanica |
Methylosinus trichosporium | |
Methylococcus capsulatus | |
Гомоацегогены. | Acetobacterium woodii |
Clostridium formicoaceticum | |
C. pasteurianum | |
C. thermoaceticum | |
Метаногены. | Methanobacterium thermoautotrophicum |
Methanosarcina barkeri | |
Methanobrevibacter arboriphilus | |
Melhanosaeta soehngenii | |
Фототрофы. | Rhodocyclus gelatinosa |
Rhodospirillum rubrum | |
Spimlina platensis | |
Сульфатредукторы. | Desulfobacterium autotrophicum |
Desulfotomaculum acetoxydans | |
Desulfovibrio vulgaris |
Каждой функциональной группой микроорганизмов использование угарного газа происходит в соответствии с реакциями:
- 7СО + 2,502+ Н20 —" (СНО) + 6СО, — для аэробных карбоксидотрофов; СО + 2Н20 —> СН/, + С02 — для метаногенов;
- 4СО + 2Н20 —> СН3-СООН + 2С02 — для гомоацетогенов;
СО + Н20 —> Н2 + С02 — для фотогрофов и анаэробных хемотрофов;
4СО + H2S04 —> 4С02+ H2S — для сульфатредукторов.
Недавно выделены термофильные водородобразующие анаэробные прокариоты, окисляющие угарный газ по реакции СО + Н20 —> С02+ Н2. Это прямые и изогнутые палочки или нити, имеющие клеточную стенку грамположигельного типа и S-слой (Carboxydothermus hydrogenojоплат, С. restrictus, Carboxydocella thermoautotrophica и др.). Многие из них обладают жгутиковой подвижностью. Они обитают в пресных и морских водоемах при температуре 80—85°С и pH, близком к нейтральному. К этой группе относится и архей рода Thermococcus, выделенный из глубоководного горячего источника. Такие микроорганизмы используют угарный газ в качестве единственного источника углерода и энергии.
Аэробные карбоксидобактерии обладают оксидазными системами, малочувствительными к угарному газу, а у анаэробов оксидазы отсутствуют. Окисление СО кислородом (типичная карбоксидотрофия) происходит, но уравнению.
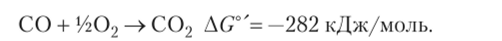
У аэробных карбоксидотрофов обнаружена Mo-Fe-флавиновая форма фермента СО-дегидрогеназы (обычно НАД+-зависимой) массой 300 кДа, состоящая из грех субъединиц, содержащая молибден и FeS-кластер. Для анаэробных бактерий и архей, окисляющих СО, показана Ni-Fe-форма этого фермента. Иногда гены, кодирующие СО-дегидрогеназу, находятся в плазмидах. Анаэробные прокариоты, имеющие ацетил-КоА-путь, могут окислять угарный газ с помощью СО-дегидрогеназы-ацетил-КоА-синтазы.