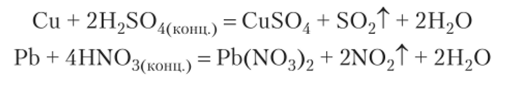Кислоты.
Химия

Если кислота содержит один такой атом водорода, то это одноосновная кислота (НС1 — соляная, HN ()3 — азотная, НСЮ — хлорноватистая, СН3СООН — уксусная); два атома водорода — двухосновная кислота (H2S04 — серная, H2S — сероводородная); три атома водорода — трехосновные кислоты (Н3Р04 — ортофосфорная, H3As04 — ортомышьяковая). Кислоты — это сложные вещества, молекулы которых состоят из одного или… Читать ещё >
Кислоты. Химия (реферат, курсовая, диплом, контрольная)
Кислоты — это сложные вещества, молекулы которых состоят из одного или нескольких атомов водорода и кислотного остатка. Состав кислот может быть выражен общей формулой HtA, где, А — кислотный остаток. Атомы водорода в кислотах способны замещаться или обмениваться на атомы металлов, при этом образуются соли.
Классификация и номенклатура кислот
Если кислота содержит один такой атом водорода, то это одноосновная кислота (НС1 — соляная, HN ()3 — азотная, НСЮ — хлорноватистая, СН3СООН — уксусная); два атома водорода — двухосновная кислота (H2S04 — серная, H2S — сероводородная); три атома водорода — трехосновные кислоты (Н3Р04 — ортофосфорная, H3As04 — ортомышьяковая).
В зависимости от состава кислотного остатка кислоты подразделяют на бескислородные (H2S, HBr, HI) и кислородсодержащие (Н3Р04, H2S03, Н2Сг04). В молекулах кислородсодержащих кислот атомы водорода связаны через кислород с центральным атомом: Н-О-Э. Названия бескислородных кислот образуются из корня русского названия неметалла, соединительной гласнойои слова «водородная» (H2S — сероводородная). Названия кислородсодержащим кислотам дают так: если неметалл (реже металл), входящий в состав кислотного остатка, находится в высшей степени окисления, то к корню русского названия элемента добавляют суффиксы -н-, -ев- или -ов- и далее окончание -ая- (H2S04 — серная, Н2Сг04 — хромовая). Если степень окисления центрального атома ниже, то используется суффикс -ист- (II2S03 — сернистая). Если неметалл образует ряд кислот, используют и другие суффиксы (НСЮ — хлорноватистая, НС102 — хлористая, НС103 — хлорноватая, НСЮ4 — хлорная).
В растворах кислот индикаторы имеют окраску: лакмус — красный, метиловый оранжевый — красный.
Получение кислот.
1. Бескислородные кислоты могут быть получены при непосредственном соединении неметаллов с водородом и последующим растворением соответствующих газов в воде:
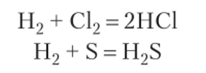
- 2. Кислородсодержащие кислоты нередко могут быть получены при взаимодействии кислотных оксидов с водой.
- 3. Как бескислородные, так и кислородсодержащие кислоты можно получить по реакциям обмена между солями и другими кислотами:
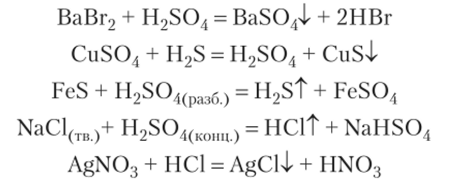
4. В ряде случаев для получения кислот могут быть использованы окислительно-восстановительные реакции:
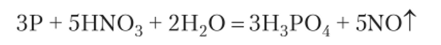
Химические свойства кислот.
1. Кислоты взаимодействуют с основаниями и амфотерными гидроксидами. При этом малорастворимые и нерастворимые кислоты (H2SiOs, Н3В03) могут реагировать только с растворимыми щелочами:
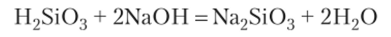
- 2. Взаимодействие кислот с основными и амфотерными оксидами рассмотрено выше.
- 3. Взаимодействие кислот с солями — это обменная реакция с образованием соли и воды. Эта реакция идет до конца, если одним из продуктов в реакции является нерастворимое или летучее вещество либо слабый электролит.
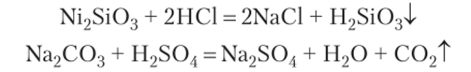
4. Взаимодействие кислот с металлами — окислительно-восстановительный процесс. Восстановитель — металл, окислитель — ионы водорода у кислот-неокислителей (НС1, HBr, HI, H2S04(pa36), Н3Р04) или анион кислотного остатка у кислот-окислителей (H2S04(KOHU)> HN03(KOH11 «разб)). Продуктами реакции взаимодействия кислот-неокислителей с металлами, стоящими в ряду напряжений до водорода, являются соль и газообразный водород:
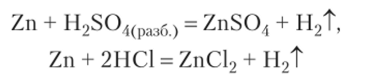
Кислоты-окислители взаимодействуют почти со всеми металлами, кроме благородных (Au, Pt), при этом образуются продукты восстановления аниона кислоты, соль и вода: