Влияние концентрации фермента

В момент времени t концентрация свободного фермента будет равна |Е01 — |ES). Если концентрация субстрата гораздо больше, чем концентрация фермента, находящегося в составе фермент-субстратного комплекса, то содержанием субстрата в этом комплексе можно пренебречь. В этом случае скорость образования фермент-субстратного комплекса будет равна: На рис. 6.4 представлено влияние концентрации фермента… Читать ещё >
Влияние концентрации фермента (реферат, курсовая, диплом, контрольная)
При условии избытка субстрата скорость реакции прямо пропорциональна концентрации фермента:
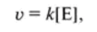
где и — скорость реакции; |Е| — концентрация фермента; к — константа скорости реакции.
На рис. 6.4 представлено влияние концентрации фермента аргиназы на скорость расщепления аргинина. Отклонение от прямо пропорциональной зависимости возможно в случае дефицита субстрата или кофермента (применительно к соответствующим сложным ферментам), наличия в реакционной среде токсических примесей.
Влияние концентрации субстрата
Одним из наиболее важных факторов, влияющих на скорость ферментативных реакций, является концентрация субстрата.
В большинстве случаев график зависимости скорости ферментативной реакции от концентрации субстрата представляет собой гиперболу (рис. 6.5).
Кривую можно разбить на два участка: участок, на котором согласно закону действующих масс скорость реакции пропорциональна концентрации реагирующих веществ, и участок, на котором скорость реакции не зависит от концентрации субстрата, она постоянна и максимальна.
Числовое значение субстрата, при котором скорость реакции равна половине максимальной скорости, называется константой Михаэлиса Км.
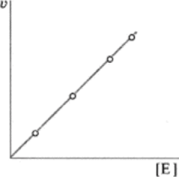
Рис. 6.4. Зависимость скорости реакции v от концентрации фермента Е.
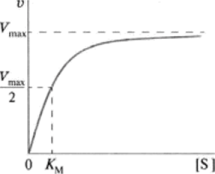
Рис. 6.5. Зависимость между скоростью реакции и концентрацией субстрата.
Основные положения ферментативной кинетики, основанные на взаимоотношениях между ферментами и различными концентрациями субстратов, были разработаны еще в 1913 г. Л. Михаэлисом и М. Мснтсн. Предложенные ими уравнения, связывающие скорость реакции с концентрацией субстрата, в дальнейшем незначительно видоизменялись, однако общие принципы остались незыблемыми. Согласно этим принципам, фермент Е и субстрат S вступают в реакцию со скоростью, константа которой обозначается к+]. При этом образуется комплекс ES, способный диссоциировать на исходные фермент и субстрат со скоростью, константа которой обозначается к_}. В случае же продуктивной ферментативной реакции из этого комплекса со скоростью к+2 выделяются фермент и продукты превращения субстрата. Моносубстратную ферментативную реакцию можно записать следующим образом:
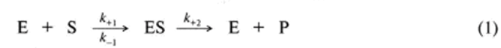
где Р — продукты превращения субстрата.
В момент времени t концентрация свободного фермента будет равна |Е01 — |ES). Если концентрация субстрата гораздо больше, чем концентрация фермента, находящегося в составе фермент-субстратного комплекса, то содержанием субстрата в этом комплексе можно пренебречь. В этом случае скорость образования фермент-субстратного комплекса будет равна:
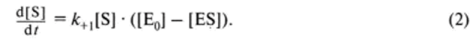
Наряду с образованием фермент-субстратного комплекса возможна его диссоциация со скоростью на фермент и исходный субстрат, а также распад с образованием продуктов реакции, протекающий со скоростью к+2. Этот процесс описывается уравнением.
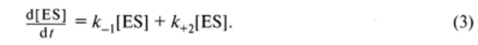
В состоянии равновесия скорость образования комплекса и его распада равна, следовательно:
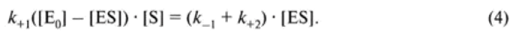
После ряда упрощений получаем: 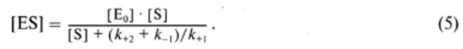
Л. Михаэлис и М. Ментен постулировали, что скорость реакции определяется как скорость распада фермент-субстратного комплекса (константа скорости равна к+2). Следовательно:

Подставляя вместо [ ESJ его значение, из уравнения (5) получаем:

Упростить это уравнение можно следующим образом: обозначим ?+2[Е0] как УтахУ т. е. скорость реакции в условиях, когда весь фермент связан с субстратом, а (А:+2 + ?_,)/?+, как константу Михаэлиса Км. При подстановке этих величин в уравнение (7) получаем:

Уравнение (8) является основным уравнением Михаэлиса—Ментен применительно к моносубстратным ферментативным реакциям. Это уравнение связывает между собой начальную скорость реакции, максимальную скорость реакции и исходную концентрацию субстрата. В случае, если начальная скорость реакции равна половине максимальной скорости реакции, уравнение (8) принимает вид:

Разделив обе части уравнения на Ктах, получаем:

Решая уравнение (10) относительно Х" м, получаем, что Км равно |S|.
Следовательно, константа Михаэлиса численно равна такой концентрации субстрата, при которой скорость ферментативной реакции равна половине максимальной.
Константа Михаэлиса имеет большое значение при исследовании ферментов; она является весьма важным параметром, характеризующим, в частности, степень сродства фермента к субстрату.
Выражение, обратное уравнению (8), представляет собой:

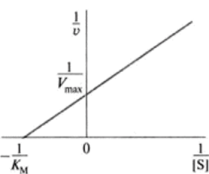
Рис. 6.6. Определение Км и У^ методом двойных обратных величин.
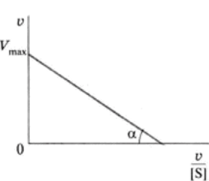
Рис. 6.7. Определение Км и У^ метолом Эли—Хофсти Это линейное уравнение Лайнуивера—Бэрка, благодаря которому возможно определять в одном эксперименте константу Михаэлиса и максимальную скорость исследуемой ферментативной реакции.
В графическом варианте метод Лайнуивера и Бэрка называют еше методом двойных обратных величин (рис. 6.6). При построении графика на оси абсцисс откладывают величину, равную 1/|S|, а на оси ординат — 1 /Утлх.
В некоторых случаях для определения константы Михаэлиса и максимальной скорости реакции более перспективным является метод Эди—Хофсти. При использовании этого метода на оси ординат откладывают v, на оси абсцисс — v/S. Полученная прямая линия отсекает на оси ординат отрезок, равный Ктах, а с осью абсцисс образует угол а, тангенс которого равен Vmax / tfN1 (рис. 6.7).