Определение нуклеотидных последовательностей (секвенирование)

Установление первичной структуры — нуклеотидной последовательности клонированного сегмента ДНК — необходимо для выяснения его структуры, функции и происхождения. В настоящее время используют модифицированный метод, сводящийся к флуоресцентному анализу наборов фрагментов ДНК в процессе движения по одной дорожке геля. За один раз секвенируют только одну цепь ДНК, помеченную радиоактивным изотопом… Читать ещё >
Определение нуклеотидных последовательностей (секвенирование) (реферат, курсовая, диплом, контрольная)
Установление первичной структуры — нуклеотидной последовательности клонированного сегмента ДНК — необходимо для выяснения его структуры, функции и происхождения.
Имеется две категории методов секвенирования ДНК. В основе методов первой категории лежат химические реакции, в которых используют непосредственно фрагменты очищенной ДНК. Во втором случае используют ДНК-копии очищенных сегментов, полученные ферментативным путем. Эти подходы имеют некоторое сходство:
- — фрагменты ДНК очищают с помощью клонирования;
- — за один раз секвенируют только одну цепь ДНК, помеченную радиоактивным изотопом, и определяют ее нуклеотидную последовательность;
- — образуется набор радиоактивно меченных одиночных цепей всех возможных длин — от 1 до п (и — полная длина секвенируемой молекулы).
Метод химического секвенирования основан на специфической модификации различных пуриновых и пиримидиновых оснований. Эти модифицированные основания выщепляются затем из полимеразной цепи с сохранением сахарофосфатного остова. Далее гидролизуют относительно нестабильные фосфодиэфирные связи, соседствующие с сайтом, где находилось удаленное модифицированное основание, в результате чего цепь разрывается (рис. 15.7).
На рис. 15.8 представлена схема химического метода секвенирования ДНК. Исходный фрагмент ДНК, меченный 32Р по 5'-концу, подвергается специфическому расщеплению по определенному нуклеотиду (например, А), в результате чего образуются радиоактивные фрагменты разной длины, которые разделяются по размерам при гель-электрофорезе, а радиоактивные из них выделяются с помощью радиоавтографии.
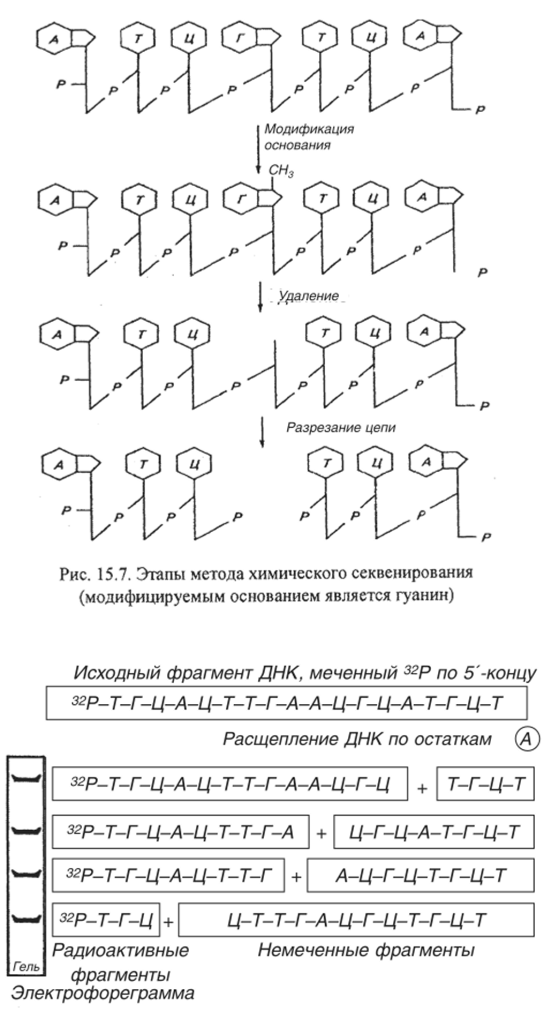
Рис. 15.8. Схема получения семейства меченных по 5'-концу фрагментов ДНК в результате расщепления по определенному нуклеотиду (А).
Энзиматический метод секвенирования основан на энзиматическом введении нуклеотида, терминирующего полинуклеотидную цепь (рис. 15.9). В этом случае обычно используют дидезоксирибонуклеозидтрифосфаты, в которых дезоксирибоза-З'-ОН, представленная в нормальных нуклеотидах, отсутствует. Такой модифицированный нуклеотид, внедряясь в цепь ДНК с помощью ДНК-полимеразы, блокирует присоединение следующего нуклеотида. Синтез in vitro молекулы ДНК в присутствии затравки (праймера) и небольшого количества одного из таких модифицированных нуклеотидов приводит к образованию фрагментов ДНК в виде «лесенки». Если для получения таких фрагментов применять меченую ДНК (обычно проводят четыре реакции синтеза с использованием различных нуклеотидов, терминирующих цепь), а электрофоретический анализ проводить на четырех дорожках геля, то можно определить последовательность нуклеотидов.
В настоящее время используют модифицированный метод, сводящийся к флуоресцентному анализу наборов фрагментов ДНК в процессе движения по одной дорожке геля.
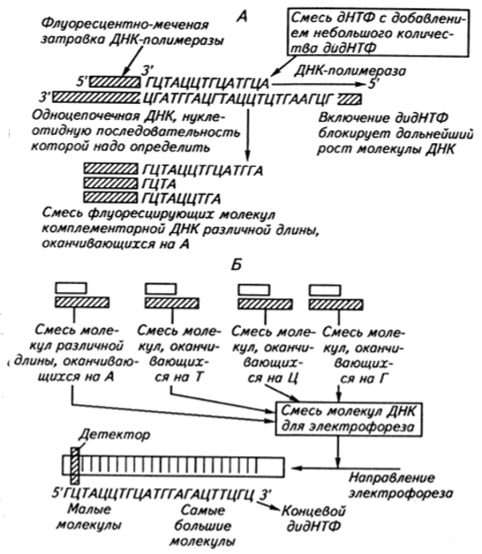
Рис. 15.9. Схема энзиматического метода секвенирования нуклеиновых кислот, основанного на энзиматическом введении нуклеотида, терминирующего цепь: а — синтез in vitro в присутствии затравки с образованием «лесенки» фрагментов; б — инкубация четырех различно окрашенных флуоресцирующих затравок в смеси нуклеотидов с добавлением различных дидНТФ, прекращающих рост цепи (А, Т, Ц, Г) Работа по определению нуклеотидных последовательностей крупных геномов, состоящих из миллионов и более нуклеотидов, значительно облегчается, поскольку существуют компьютерные программы, с помощью которых можно быстро найти перекрывающиеся последовательности в анализируемых фрагментах, а затем составить полную карту генома.