Индуцированные механизмы защиты

Известно, что ЛФК могут вступать в реакцию с полиненасыщенными жирнокислотными цепями в составе фосфолипидов мембран и тем самым вызывать перекисное окисление липидов (см. параграф 4.4). Из продуктов окисления кислородом ненасыщенных жирных кислот у растений синтезируются оксилипины при помощи липоксигеназ, катализирующих включение атомов кислорода в молекулу жирной кислоты. При повреждении… Читать ещё >
Индуцированные механизмы защиты (реферат, курсовая, диплом, контрольная)
Индуцированные механизмы защиты от патогенов — это комплекс ответных физиологических процессов и биохимических реакций растенияхозяина на инфекцию.
В случае инфекции самый сильный ответ растения — реакция сверхчувствительности. Реакция сверхчувствительности (реакция СВЧ) эго быстрое программируемое отмирание инфицированных клеток растения, а также клеток, расположенных рядом с погибшими, в результате патогены блокируются слоем мертвых клеток, не могут заразить соседние клетки и погибают из-за отсутствия пищи и высоких концентраций токсинов в погибших клетках. Таким образом, растение жертвует частью клеток для спасения всего организма.
У растений реакция СВЧ возникает при первом контакте с вирусами, бактериями, грибами, нематодами. Ферменты патогена разрушают клеточные стенки, продукты разрушения индуцируют реакцию СВЧ, одновременно вещества протопласта превращаются в пищу для патогенов. Скорость реакции СВЧ велика. Так, при контакте несовместимой расы возбудителя фитофтороза с листом картофеля клетки отмирают уже через 30 мин.
Внешним проявлением реакции СВЧ является образование небольших некротических пятен, чаще на листьях. Одной из причин некроза является лигпификация и суберииизация (от лат. suber — пробка) клеточных стенок растения.
Лигнификация широко распространена как ответ на заражение. Отложение лигнина в клеточных стенках повышает механическую прочность стенки, затрудняет проникновение паразитов, так как лишь немногие из них способны расщеплять лигнин, ограничивает распространение токсинов и приток питательных веществ из клеток хозяина к клеткам паразита, защищает клеточные стенки от ферментов паразита. При инфекции лигнифицируются даже стенки клеток, в которых в норме лигнина не бывает. Кроме того, лигнин растения-хозяина может откладываться в клеточной стенке грибных гиф, останавливая их рост. Индуцирует такого рода лигнификацию хитин стенки гриба.
Затем некротическая ткань окружается перидермой, содержащей пробковую ткань, отделяющую живые клетки от инфицированных.
Скорость суберинизации поверхности раны коррелирует с устойчивостью к тем паразитам, которые внедряются только через ранки. Образование суберина требует большого количества энергии, поэтому помещения, предназначенные для длительного хранения овощей, снабжаются устройствами для продувания воздуха с определенной температурой и влажностью.
У разных растений перидерма образуется в разных местах. Например, медуница темнеющая образует перидерму вокруг зоны, содержащей инфицированные грибами клетки. У фасоли обыкновенной перидерма образуется в основании листочка сложного листа, который опадает, и, следовательно, инфекция не распространяется.
Кроме того, в месте проникновения патогена увеличивается содержание каллозы — нерастворимого в воде полисахарида, молекула которого состоит приблизительно из 100 остатков глюкозы, соединенных между собой р-1,3-связями. Она функционирует в растении как универсальный изолирующий материал. Большие количества каллозы могут синтезироваться на плазмалемме как ответная реакция на поранение. У поврежденных клеток плазмодесмы и ситовидные трубки закупориваются каллозой, чтобы предотвратить повреждение других клеток. Синтез ее стимулируется повышением концентрации кальция в цитозоле.
Если возбудитель образует на поверхности листа присоску (апрессорий) для преодоления клеточной стенки, то непосредственно иод ним клеточная стенка утолщается. Образуется бугорок, содержащий лигнин и кремний. Его формирование не позволяет паразиту проникнуть в клетку.
Реакция сверхчувствительности приводит к локализации очага заболевания. Чем устойчивее растение, тем быстрее гибнут клетки с находящимся в них патогеном и тем меньшее число слоев клеток отмирает. У восприимчивых сортов клетки тканей остаются живыми, и по ним паразит распространяется. Основная функция реакции СВЧ — подавление спороношения паразита, которое происходит лишь при его контакте с живыми клетками.
Последующее изучение появления некрозов показало, что реакция СВЧ начинается быстрым и массовым образованием активных форм кислорода, особенно 02, Н202, и токсинов, которые убивают клетки патогена. Окислительный взрыв запускает реакцию СВЧ. Следовательно, образование АФК — это не только средство нападения патогена, но и орудие растения для защиты от патогена. У растений основное место генерации АФК — хлоропласта и митохондрии, также АФК может образовываться на клеточной стенке и плазмалемме.
В плазмалемме расположена НАДФН-оксидаза, с участием которой идет реакция:
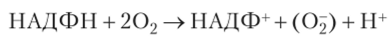
Образующийся супсроксидрадикал защищает растение от внедрения патогена. Ферменты супероксиддисмутаза (СОД) и каталаза, подавляющие образование супероксидрадикала, одновременно тормозят образование некрозов и фитоалексинов (см. далее). Паразиты защищаются от активного кислорода растения с помощью своих антиоксидантов.
Известно, что ЛФК могут вступать в реакцию с полиненасыщенными жирнокислотными цепями в составе фосфолипидов мембран и тем самым вызывать перекисное окисление липидов (см. параграф 4.4). Из продуктов окисления кислородом ненасыщенных жирных кислот у растений синтезируются оксилипины при помощи липоксигеназ, катализирующих включение атомов кислорода в молекулу жирной кислоты. При повреждении тканей активность липоксигеназ увеличивается. Среди оксилипинов фунгициды, бактерицидные вещества, инсектициды, а также вещества, привлекающие хищных и паразитических насекомых, которые питаются насекомыми-вредителями. К оксилипинам относят и травматин — специфический раневой гормон, стимулирующий деление клеток, соседних с поврежденными, что вызывает образование каллуса и закрывание ранки.
Перекисное окисление липидов опасно для клетки, поэтому в ней имеется специальная антиоксидантная система (см. параграф 4.6). В частности, токоферол, связывая АФК, регулирует уровень перекисного окисления липидов. Его много в мембранах клеток устойчивых сортов. Если с его помощью подавить активность липоксигеназы, то некроз не образуется.
Стресс сопровождается также изменением активности антиоксидантных ферментов. Полагают, что уровень антиоксидантной защиты и способность быстро реагировать на опасную ситуацию увеличением ее активности определяют устойчивость растений к стрессу. Поврежденная клетка отключает систему защиты от АФК, образуется много перекисей, АФК, и клетка погибает. Вместе с ней гибнет и проникший в нее патоген.
Последний этап реакции сверхчувствительности — синтез специфических белков и вторичных метаболитов. Клетки, окружающие зону инфекции, синтезируют токсичные вещества — фитоалексины, лектины, дефензины. В свою очередь, патогены имеют ферменты, разрушающие защитные вещества, синтезируемые растением-хозяином.
Дефепзииы — небольшие полипептиды, которые синтезируются в ответ на заражение бактериями или грибами. Они изменяют мембранный потенциал клетки, не нарушая структуру мембран.
Фитоалексипы (от греч. а1ехо — отражаю, защищаю) как защитные вещества, синтезируемые в растении в ответ на заражение грибами, были открыты в 1940 г. К. Мюллером и Г. Бергером (Германия). Позднее было доказано, что фитоалексины образуются при нападении не только грибов, но и бактерий, вирусов и даже под влиянием абиотических факторов — УФ-радиации, температурного шока, тяжелых металлов, при ранении. Образование фитоалексинов — важная фаза реакции СВЧ. Они выделены из листьев, стеблей, корней и плодов растений, хотя не всегда представлены во всех органах.
Фитоалексины — это низкомолекулярные вещества, слабые антибиотики, продуцируемые клетками растения-хозяина. Они относятся к гетероциклическим соединениям и разнообразны по своей природе: у бобовых — флавоноиды, у пасленовых — сесквитерпены, у астровых — полиацетилены.
(рис. 10.3). Общее свойство большинства фитоалексинов — растворимость в липидах.
Рис. 103. Химические формулы некоторых фитоалексинов
Названия фитоалексинов часто происходят от латинских названий родов растений: у гороха (Pisum) — пизатин, сои (Glycine) — глицеоллин, фасоли (Phaseolus) — фазеоллин, люцерны (Medicago) — медикарпин. Сейчас известно свыше 350 фитоалексинов для растений 200 семейств. Иногда одно растение имеет несколько фитоалексинов, например у конских бобов {Vicia fabo) при заражении образуется по крайней мере семь различных фитоалексинов. Наличие нескольких фитоалексинов помогает лучше бороться с инфекцией, поскольку патогены быстро привыкают к антибиотикам, а привыкнуть к нескольким фитоалексинам труднее, чем к одному.
Фитоалексины обычно не присутствуют в здоровом растении, их синтез начинается при контакте растения с паразитом. Инфицирование растения приводит к активизации ФАЛ и быстрому синтезу фитоалексинов, так как ФАЛ участвует в биосинтезе фенолов. Некоторые фитоалексины образуются сразу после заражения, другие — через несколько суток. Разные виды грибов обладают разной чувствительностью к ним.
Фитоалексины синтезируются в здоровых клетках, примыкающих к инфицированным, но из-за своей токсичности не накапливаются в живых клетках, а сразу транспортируются в погибшие клетки. Быстрота и количество накопления зависят от синтеза de novo и от освобождения их из конъюгатов. Таким образом, к приходу патогена в мертвых клетках должны накопиться большие концентрации фитоалексинов. Если растение успевает это сделать, патоген погибает.
В настоящее время индукция синтеза фитоалексинов рассматривается как основное защитное приспособление высших растений. Образование фитоалексинов вызывают элиситоры. Элиситорами для образования фитоалексинов могут служить фрагменты клеточной стенки самого патогена, которые образуются под действием защитных ферментов растения; ферменты, выделяемые патогеном для разрушения клеточной стенки растения или его кутикулы; вещества, выделенные из мицелия грибов (белки, липиды, гликопротеиды, ферменты, ненасыщенные жирные кислоты).
Некротизация тканей растения также индуцирует синтез фитоалексинов. Продукты, возникающие при разрушении клеточных стенок растения патогенами, сами являются первыми элиситорами их синтеза. В этом случае олигосахаринные элиситоры синтеза фитоалексинов представляют собой фрагменты пектинового матрикса, построенного из остатков галактуроновой кислоты, которые высвобождаются из клеточной стенки растения при действии ферментов, секретируемых либо внедряющимся патогеном, либо в некоторых случаях ферментами растительной клетки, активированными при повреждении.
Различные фитоалексины действуют на патоген по-разному: повреждают плазмалемму, увеличивая вымываемость веществ из клеток, повреждают мембраны митохондрий, разобщают дыхание и транспорт электронов в электронтранспортной цепи, дезактивируют экзоферменты паразитов.
Сможет ли данный фитоалексин защитить растение, зависит от многих факторов. Очень важно, насколько быстро растение узнает патоген и отреагирует на него. Нередко фитоалексин начинает вырабатываться после заражения слишком поздно, когда гриб уже успел распространиться в ткани. В других случаях оказывается, что гриб может разлагать данный фитоалексин специальными ферментами или прекращать его синтез и благодаря этому распространяется.
Установлен ряд механизмов детоксикации фитоалексинов грибами. Для изофлавоноидов двумя важными этапами этих механизмов являются гидроксилирование ядра и деметилирование метоксильных групп. В результате понижается растворимость фитоалексинов в липидах и повышается их растворимость в воде. Продукты этих реакций подвергаются окислительной деградации с разрывом ароматических колец и образованием диоксида углерода. Для выживания гриба критическим моментом является время, в течение которого образуются инактивирующие ферменты.
Существует прямая корреляция между накоплением фитоалексинов и устойчивостью. Если у растения ингибировать синтез фитоалексинов, то оно становится восприимчивым не только к «своему», но и к другим патогенам, никогда раньше не поражавшим это растение. Устойчивые и восприимчивые клетки растения отличаются по скорости образования фитоалексина, которая зависит от генотипа растения. Однако устойчивое состояние не наследуется, оно развивается в результате инфекции.
Фитоалексины можно использовать для защиты культурных растений. Например, фитоалексины перца могут подавлять заболеваемость томата фитофторозом. Еще один путь применения фитоалексинов в защите урожая заключается в активировании их синтеза в ноле абиотическими средствами. Например, обработка растений риса некоторыми фунгицидами индуцирует интенсивный синтез фитоалексинов.
Итак, фитоалексины — это антимикробные вещества, которые продуцируются растениями как часть реакции СВЧ и синтез которых может запускаться под воздействием различных факторов. С точки зрения болезнеустойчивости растений, очень важно, что способность к синтезу фитоалексинов включает в себя способность продуцировать их быстро, в достаточном количестве, в нужном месте и в нужное время.
Белки, связанные с патогенезом (PR-белки) (от англ, pathogenesis related proteins) — группа разнообразных растительных белков, токсичных для патогенов, синтез которых включается в ответ на грибные, бактериальные, вирусные инфекции, поранение. Доказательство роли PR-белкои в защите растений было получено на трансгенных растениях табака и томата. При образовании больших количеств этих белков у растений возрастала устойчивость.
PR-белки представляют собой в основном гидролазы, среди которых имеются глюканазы и хитин азы, разрушающие клеточные стенки грибов и бактерий. Эти ферменты находятся в клеточной стенке растений и в вакуолях. Глюканазы расщепляют глюканы клеточной стенки. Фрагменты глюканов сами способны вызвать иммунную реакцию растительных клеток. Хитиназы расщепляют хитин клеточных стенок грибов. В результате разрушения клеточных стенок образуются олигосахарины, индуцирующие синтез фитоалексинов. Продукты гидролиза клеточных стенок растения используют в качестве элиситоров для образования защитных PR-белков. Эти агрессивные ферменты инактивируются, когда с ними связываются таннины.
Тионины — небольшие богатые цистеином белки, находящиеся в клеточных стенках растения. Связываясь с мембранами патогена, они нарушают их структуру и проницаемость. Однако тионины токсичны и для самого растения.
Кроме АФК, фитоалексинов и лектинов, к месту повреждения транспортируются ингибиторы протеиназ.
Ингибиторы протеиназ — особая группа белков растений, способных образовывать комплексы с протеиназами как микроорганизмов, так и насекомых, что приводит к потере ферментами активности. Если протеиназы вызывают распад белка, то ингибиторы протеиназ защищают белки растительных клеток от ограниченного протеолиза (см. параграф 1.2). В результате останавливается разрушение белков, в том числе и клеточных стенок растения, а патоген не может использовать эти белки для питания.
Ингибиторы протеиназ присутствуют в растениях разных семейств. Особенно много их в листьях, корнях, зерновках злаков, семенах бобовых, подсолнечника, клубнях картофеля, топинамбура. Их содержание может составлять до 5—10% водорастворимых белков клетки. Среди них есть ингибиторы и а-амилаз.
Элиситоры патогенов могут индуцировать накопление ингибиторов протеиназ в тканях растений. Полагают, что синтез ингибиторов протеинкиназ может локально индуцироваться небольшими фрагментами полисахаридов, входящих в состав пектина и освобождающихся при повреждении.
Обнаружен и другой механизм инактивации патогенов белками семян растений. Так, в семенах ячменя содержится белок с молекулярной массой 30 кДа, который вызывает инактивацию рибосом гриба Тпскодегта геезел.
Другой причиной отмирания клеток является повышение активности окислительных ферментов — полифенолоксидазы и пероксидазы, с их помощью фенолы превращаются в хиноны. Пропитанные хинонами клетки не могут быть питательной средой для микроорганизмов, таким образом, создается химический барьер для проникновения патогена. Однако хиноны живут недолго, они быстро окисляются, а вновь возникающие вещества уже мало токсичны и не могут повреждать клетки.
Полифенолоксидаза и пероксидаза ингибируют гидролазы грибов, поэтому грибы не получают питательных веществ. Кроме того, эти ферменты обезвреживают токсины, выделяемые патогеном, окисляя их до нейтральных веществ, а также окисляя фенолы до хинонов.
Пероксидазы участвуют также в синтезе лигнина и суберина, перекрестной сшивке белков клеточной стенки, что укрепляет стенки клеток, препятствуя прорастанию спор и росту мицелия. У иммунных сортов в ответ на заражение активность пероксидазы увеличивается.
Устойчивые растения в дополнение к ингибированию гидролитических процессов, развивающихся в их тканях под влиянием патогенов, активируют процессы синтеза. Синтезируются не только защитные соединения (фитоалексины, белки и др.), но и вещества, помогающие поддерживать структуру и жизнедеятельность клетки.
Еще одна возможность поддержания устойчивости растения — регуляция растением-хозяином образования соединений, необходимых для паразита. Так, возбудитель фитофтороза картофеля оомицет РкуШрЫога т/езЬат не способен синтезировать стеролы, нужные ему для образования спор, и получает их из растения-хозяина. У устойчивых к фитофторе сортов в месте инфицирования клетки в ответ на заражение вместо стеролов синтезируются фитоалексины. В результате патоген не только лишается необходимых ему стеролов, но и разрушается фитоалексинами. Недостаток стеролов, повреждая мембраны, делает клетки патогена чувствительнее к действию фитоалексинов.
Итак, реакция СВЧ — это комплекс защитных реакций организма, включающий лигнификацию, суберинизацию клеточных стенок, некротизацию клеток и образование механических барьеров, изменение pH, синтез ключевых ферментов реакций защиты (ФАЛ, липоксигеназы), накопление РК-белков, фитоалексинов, синтез вторичных метаболитов, ингибиторов протеиназ. Одним из индукторов, вызывающих реакцию СВЧ, являются АФК. В результате растение приобретает устойчивость к патогенам, ранее вызвашим заболевание. Реакция сверхчувствительности — это один из самых эффективных способов защиты, обеспечивающих растению устойчивость к грибам, вирусам и бактериям. Она обеспечивает устойчивость всего растения и лежит в основе большинства известных в настоящее время проявлений фитоиммунитета не только в отношении специфических, но и неспецифических патогенов.
В борьбе с патогенами участвуют и гормоны растения-хозяина. Так, ауксины повышают устойчивость клеточных стенок к ферментам, разрушающим пектиновые вещества. Брассиностероиды повышают устойчивость растений к вирусам и грибам.
Заражение растения патогеном сопровождается выделением этилена. Его концентрация начинает увеличиваться еще до начала реакции СВЧ. Элиситоры из клеточных стенок растений и грибов повышают выделение этилена. Этилен индуцирует синтез ферментов, разрушающих клеточные стенки патогена, синтез РЯ-белков, активирует ФАЛ и пероксидазу, участвуя тем самым в лигнификации клеточных стенок, включает синтез фитоалексинов. Этилен активизирует образование раневой перидермы.
В природе механические повреждения растений вызываются ветром, животными, птицами, насекомыми, прорастающими спорами патогенов. Растение должно различать абиогенное повреждение от биогенного. Для этого иод действием этилена клетки выделяют в апопласт хитиназу и р-глюканазу. Хитиназа разрушает хитин, содержащийся в стенках грибов или образующий наружный скелет насекомого, а глюка — наза — клеточную стенку растения с образованием глюканов. Поскольку хитиназы сначала образуется мало, она не может нанести большой вред грибу или насекомому. Однако образующиеся из хитина и гликана олигосахарины воспринимаются растением как сигналы об опасности, и начинается второй этап ответа на повреждение — синтез защитных веществ. Если хитиназа и глюканаза не обнаруживают грибов в месте повреждения растения, то токсичные вещества перестают вырабатываться.
Выделяясь из поврежденных тканей, этилен может передавать информацию неинфицированным органам о нападении патогена.
Некоторые грибы, например вызывающие ржавчину, нуждаются для своего роста в полиаминах (путресцине и спермине), синтезируемых растением. Этилен и полиамины синтезируются из одного вещества-предшественника — Э-аденозилметионина, поэтому синтез этилена в ответ на стресс останавливает синтез полиаминов. Лишенные иолиаминов грибы хуже инфицируют растение. Уменьшение синтеза этилена вызывает усиление заболевания.
Повреждение листа вызывает накопление абсцизовой кислоты, что, в свою очередь, индуцирует синтез РЯ-белков в растениях, а также накопление салициловой и жасминовой кислот.
Салициловая и жасминовая кислоты, которые синтезируются под действием этилена, играют важную роль в реакции СВЧ. Эти кислоты вначале даже получили название гормонов стресса, однако последующее их изучение показало, что они выполняют и другие функции (см. параграф 7.2).
Концентрация салициловой кислоты увеличивается при инфекции и механическом повреждении тканей. Сначала активируется синтез ФАЛ — начальный фермент синтеза салицилата. В результате концентрации салицилата увеличиваются в десятки раз. Высокие дозы салицилата индуцируют реакцию СВЧ — увеличивается синтез фитоалексинов, фенолов, подавляющих развитие патогена, синтез веществ, укрепляющих клеточные стенки, синтезируются РЯ-белки.
Салицилат может связываться с некоторыми Ее-содержащими ферментами, например каталазой. В результате активность каталазы падает. Следовательно, салицилат регулирует процессы не только через рецепторы, но и непосредственно участвует в аллостерической регуляции работы некоторых ферментов (см. параграф 1.2). Снижение активности каталазы приводит к увеличению концентрации перекиси водорода и других активных форм кислорода. Это увеличивает образование новых порций салициловой кислоты.
Накопление перекиси водорода влияет на транскрипцию генов, контролирующих синтез РЯ-белков. Кроме того, под влиянием перекиси водорода полипептидные цепи белка экстенсина соединяются между собой в трехмерную структуру, что усиливает прочность стенок живых клеток.
После затухания реакции сверхчувствительности салицилат образует конъюгаты с глюкозой.
Жасминовая кислота и ее метиловый эфир усиленно образуются при механическом повреждении растения, вызванном насекомыми, прорастающими спорами патогена или травоядными животными, о чем уже говорилось. Резкое увеличение ее концентрации индуцирует синтез таких гормонов, как салициловая кислота, системин, а также защитных веществ, подавляющих развитие патогена, увеличивающих прочность клеточной стенки, активирует синтез ингибиторов протеиназ, ФАЛ, тионинов, освобождает алкалоиды из связанного состояния. При повреждении травоядными животными жасминат стимулирует в растениях синтез ингибитора трипсина, что нарушает у них пищеварение.
Жасминовая кислота вместе с салицилатом и этиленом регулирует экспрессию нескольких сотен генов устойчивости, кодирующих синтез разнообразных белков, называемых ЖАК-индуцируемыми белками. К этим генам относятся гены, участвующие в окислительном взрыве, гены контроля синтеза РЯ-белков, синтеза экстенсина, лигнина, суберина, тионинов, фитоалексинов, фенолов, ингибиторов протеаз, белков с фунгицидной активностью, гены контроля синтеза триптофана и синтеза жирных кислот, а также гены, участвующие в передаче сигнала.
Подобно другим гормонам, инициировав ответную реакцию, жасминовая кислота переходит в связанную форму, что защищает растение от повторной инфекции.
В ответ на повреждение клеток насекомыми в растении синтезируется системин (см. параграф 7.2). Из поврежденных клеток он транспортируется в неповрежденные участки растения по флоэме, где включает синтез жасминовой кислоты, возможно АБК и этилена, а также ингибиторов протеаз. Синтез системина контролируют 20 генов.
Поскольку жасминовая и салициловая кислоты, АБК и системин могут транспортироваться по флоэме, а количество их увеличивается при инфицировании, они могут служить сигнальными веществами, передающими информацию о заражении растения тканям, расположенным на значительном расстоянии от поврежденных клеток. Метиловый эфир жасминовой кислоты является газообразным соединением, с его помощью информация о нападении патогена и повреждении некоторых клеток может передаваться по воздуху не только неповрежденным органам, но и соседним растениям. Аналогичную функцию выполняет и этилен. Устойчивость всего растения далеко от места контакта с патогеном называют системной устойчивостью.
Уже давно известно, что у инфицированного растения резко увеличивается интенсивность дыхания. Своего максимального значения она достигает обычно через несколько дней или недель после внедрения патогена и может превышать интенсивность дыхания здорового растения в несколько раз; позднее наблюдается спад интенсивности дыхания. Эта вспышка дыхания, прежде всего, связана с реакцией СВЧ, которая является энергозависимым процессом и происходит только в живых, активно дышащих клетках. В тканях, отравленных наркотическими веществами или обработанных дыхательными ядами (динитрофенолом, ЫаЫ3), реакция СВЧ ингибируется. АТФ нужна также для синтеза защитных веществ. Кроме того, промежуточные продукты дыхания являются материалом для синтеза защитных веществ. Например, усиление пентозофосфатиого пути дыхания приводит к повышению содержания эритрозо-4-фосфата, нужного для образования фенолов.
У устойчивых сортов при биотическом стрессе увеличиваются число митохондрий, скорость транспорта электронов по дыхательной цепи и скорость синтеза АТФ; у неустойчивых сортов скорость распада дыхательного субстрата увеличивается, однако скорость синтеза АТФ снижается (Р/О падает).
Итак, усиление образования АФК, увеличение активности окислительных ферментов и ферментов, играющих ведущую роль в синтезе фитоалексинов и антипатогенных веществ, накопление ингибиторов протеаз, Р/?-бел ко в, фитонцидов, фенолов и хинонов, таннинов, дефензинов и других повышают устойчивость к болезням.