Гальванические преобразователи.
Изготовление биотехнических и медицинских аппаратов и систем

Таким образом, для характеристики раствора достаточно знать активность водородных ионов, которую для удобства записи и вычислений численно характеризуют отрицательным логарифмом активности ионов водорода — водородным показателем pH: Каломельный полуэлемент. Потенциал Е0 нормального каломельного полу элемента относительно потенциала нормального водородного полуэлемента при температурах 15, 18, 20… Читать ещё >
Гальванические преобразователи. Изготовление биотехнических и медицинских аппаратов и систем (реферат, курсовая, диплом, контрольная)
Гальванические преобразователи основаны на зависимости ЭДС гальванической цепи от концентрации ионов в электролите и окислительно-восстановительных процессов, происходящих на электродах. Они используются для определения концентрации ионов в различных растворах, а также в качестве образцовых мер ЭДС — нормальных элементов.
Наиболее широкое применение гальванические преобразователи получили в качестве преобразователей рН-метров — приборов для измерения активности (концентрации) водородных ионов.
Молекулы воды частично диссоциируют на ионы водорода и ионы гидроксила ОН-, чем обусловлена вполне определённая, хотя и очень малая электропроводность воды. Диссоциация воды происходит по схеме.
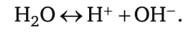
При этом остаётся постоянной так называемая константа диссоциации, равная.
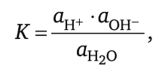
где ан+, аон_, и аНг0 — соответственно активности ионов Н+, ОН~ и воды.
В разбавленных растворах активность воды аН20 можно считать постоянной, тогда произведение К ? аНг0 становится новой постоянной, которую называют ионным произведением воды: К ? аНг0 = ан+ аон_. Установлено, что при 22 °C ионное произведение воды К-аН20 =10-14 (г-ион/л)2.
В чистой воде или в нейтральном растворе активности Н+ и ОН~ равны.

Ионное произведение воды К-аН20 -aH+aQH_ — при данной температуре остаётся постоянной величиной не только для воды, но и для любого водного раствора, включая растворы кислот с избытком ионов Н+ или оснований с избытком ионов ОН-.
Если в воде растворить кислоту, то ионов Н+ станет больше, а ионов ОН- — меньше (за счёт воссоединения части образовавшихся ионов Н+ с ионами ОН-), но произведение ан+ -аон_ останется равным ионному произведению воды. У кислых растворов ан+ > аон_, а у щелочных растворов аон_ > ан+.
Таким образом, для характеристики раствора достаточно знать активность водородных ионов, которую для удобства записи и вычислений численно характеризуют отрицательным логарифмом активности ионов водорода — водородным показателем pH:

Приборы для измерения этого показателя получили название рН-метров.
Диапазон изменения pH водных растворов обычно составляет О—14 ед. В растворах других растворителей (неводных) диапазоны изменения pH другие, например в аммиаке 0—32,7 ед., в муравьиной кислоте — 0—6,1 ед. и т. д.
Наиболее точный и универсальный метод измерения pH основан на определении электродных потенциалов различных электродов, помещаемых в исследуемый раствор. Следовательно, гальванические преобразователи, являющиеся датчиками pH-метров, в качестве естественнои входной величины имеют концентрацию водородных ионов, выражаемую в единицах pH, а в качестве выходной величины — разность электродных потенциалов.
Гальванический преобразователь состоит из двух полуэлементов: измерительного электрода, помещаемого в исследуемый раствор, и вспомогательного полуэлемента, электродный потенциал которого должен оставаться постоянным.
На рисунке 10.3 показан гальванический преобразователь, состоящий из двух водородных полуэлементов. Один из водородных электродов (измерительный) помещается в исследуемый раствор 1, который при помощи электролитического ключа 2 соединяется с нормальным водородным полуэлементом (вспомогательным) 3, содержащим электролит с активностью водородных ионов а(н+)2 =1 г-ион/л. ЭДС между электродами полученной концентрационной цепи равна.

где а(н+)1 — активность водородных ионов в исследуемом растворе; а(н+) — активность водородных ионов в нормальном водородном полуэлементе.
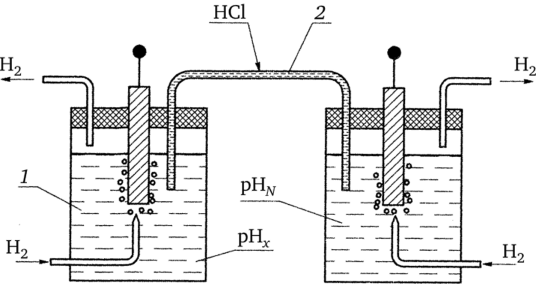
Рис. 10.3. Гальванический преобразователь, состоящий из двух водородных полуэлементов.
Переходя к десятичным логарифмам и учитывая, что lga(H+:)i =-рН, получаем.

для температуры 18 °С:
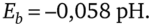
При использовании водородного электрода в рабочем (измерительном) полуэлементе им можно измерять pH во всём диапазоне измерения (от 0 до 14). Однако вследствие неудобства применения, связанного с необходимостью непрерывно подавать к электроду газообразный водород, водородный электрод используется главным образом как образцовый электрод для лабораторных исследований.
Вспомогательные полуэлементы. В гальванических преобразователях используются каломельный, хлорсеребряный, бромсеребряный и другие вспомогательные полуэлементы.
Каломельный полуэлемент. Потенциал Е0 нормального каломельного полу элемента относительно потенциала нормального водородного полуэлемента при температурах 15, 18, 20, 25 и 30 °C соответственно составляет 0,2852; 0,2845; 0,2840; 0,2828 и 0,2816 В.
Гальванический преобразователь, состоящий из водородного электрода, помещённого в исследуемый раствор, и нормального каломельного полуэлемента, будет при 18 °C развивать ЭДС.
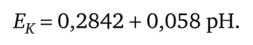
Недостатками каломельных полуэлементов являются возможность попадания ртути в контролируемый раствор и ограниченный сверху до +70 °С диапазон рабочих температур.
Хлорсеребряный полуэлемент представляет собой платиновую проволоку, покрытую слоем хлористого серебра и погруженную в раствор НС1. Нормальный потенциал хлорсеребряного полуэлемента равен 0,222 В при 25 °C. Достоинствами такого полуэлемента является простота и компактность конструкции, хорошая воспроизводимость потенциала электрода, возможность применения при температурах до 150…250 °С, а также в условиях тряски и вибраций.