Электрическая активность магноцеллюлярных нейронов гипоталамуса и ее связь с выделением окситоцина

А: 1,2,3 — импульсная активность трех окситоцинпродуцирующих нейронов гипоталамуса крысы (по Линкольн 1987); б — значение концентраций окситоцина у лактирующих крыс (по Higushi et al., 1986): а), б), в) — базальная концентрация окситоцина в крови соответственно перед приложением крысят к соскам, в момент приложения к соскам А—5 крысят и приложения 9—10 крысят; 1,2,3 — пики импульсного повышения… Читать ещё >
Электрическая активность магноцеллюлярных нейронов гипоталамуса и ее связь с выделением окситоцина (реферат, курсовая, диплом, контрольная)
Так же как нервные клетки других отделов нервной системы, крупноклеточные нейроны гипоталамуса генерируют потенциалы действия. На соме магноцеллюлярных нейронов крысы отростки нервных клеток, находящиеся в различных участках мозга, образуют около 5000 синаптических окончаний (Линкольн, 1987). В соответствии с медиаторами, которые выделяются из этих синапсов, мембранный потенциал нейросекреторных клеток может изменяться в сторону деполяризации или гиперполяризации. В случае деполяризации при достижении порогового уровня мембранного потенциала сома крупноклеточного нейрона генерирует потенциалы действия, которые распространяются по аксону, достигая терминалей задней доли гипофиза и вызывая выделение окситоцина. Частота потенциалов действия определяется мембранным потенциалом клетки, который, в свою очередь, является функцией интенсивности и сбалансированности многочисленных возбуждающих (деполяризующих) и тормозящих (гиперполяризующих) синаптических сигналов. Поскольку сома нейросекреторной клетки имеет довольно большие размеры (около 30 мкм) (см. рис. 3.22, в), ее электрическую активность можно сравнительно легко исследовать с помощью экстраи внутриклеточных электродов. Такие эксперименты можно, конечно, проводить только на животных. В настоящее время для измерения электрической активности магноцеллюлярных клеток используют два основных подхода. Первый метод включает острый эксперимент на анестизированном животном, помещенном в стереотаксический станок. Преимущество этого метода заключается в том, что параллельно с записью электрической активностью можно регистрировать дополнительные физиологические параметры. Другим методом является использование срезов гипоталамуса толщиной 100 мкм, которые помещают в культуральную среду (Jourdain et al., 1998). Срезы могут сохранять жизнеспособность в течение суток, что облегчает изучение реакции нейронов на различные фармакологические вещества (нейромедиаторы, регуляторные пептиды и т. д.). В этом случае не создают трудностей и размеры животного, будь это срезы, полученные от гипоталамуса крысы или коровы (Линкольн, 1987). Следует отметить, что были проведены опыты по регистрации импульсной активности у неиммобилизированного, находящегося в сознании животного (крысы) (Summerlee, Lincoln, 1981). Этот подход хотя и возможен, но, как показала практика, довольно труден.
При регистрации импульсной активности от магноцеллюлярных нейронов крысы описанными методами во всех случаях была зарегистрирована импульсная активность в отсутствии какой-либо сенсорной стимуляции. Эта импульсация получила название спонтанной импульсной активности. Частота спонтанной активности находится в пределах 1—5 имп/с. При уменьшении (деполяризации) мембранного потенциала сомы клетки электрическим током с помощью внутриклеточного электрода клетки генерировали серию потенциалов действию. И наоборот, увеличение мембранного потенциала (гиперполяризация) сопровождалось исчезновением спонтанной импульсации. Здесь интересно отметить, что терминали аксонов нейросекреторных клеток также способны генерировать потенциалы действия. В опытах на изолированных нейрогипофизах крыс (Bourque et al., 1990) удалось ввести кончик электрода внутрь нервной терминали. Амплитуда и длительность потенциалов действия, которые генерировала нервная терминалу были аналогичны таковым сомы нейрона. Однако в отличии от сомы клетки, в ответ на продолжительную деполяризацию мембрана терминали генерировала только один потенциал действия.
При генерации потенциала действия аксонной терминалью происходит поступление внутрь терминали ионов натрия, что, в свою очередь, приводит к открытию кальциевых каналов, через которые ионы кальция поступают в терминаль (рис. 3.24).
Увеличение концентрации ионов кальция вызывает перемещение нейросекреторных гранул к наружной мембране терминали. Мембраны гранул и терминали сливаются, и содержимое гранул выделяется из клетки в экстраклеточное пространство. Как уже говорилось, данный способ выведения вещества из клетки называется экзоцитозом. Далее окситоцин из экстраклеточного пространства диффундирует через фенестрированные капилляры (Seyama et al., 1980с) в общий кровоток. Затем восстанавливается status quo в терминали. Для этого необходимо, чтобы уменьшилась площадь мембраны терминали, снизилась внутриклеточная концентрация кальция и восстановился мембранный потенциал. Данные исследований с использованием меченой 3Н-холином мембраны гранул показывают, что происходит обратный захват мембраны гранул, которая появляется в терминалях гипофиза крыс в виде крупных пузырьков, направляющихся к соме клетки. Избыточное количество ионов кальция секвестируется в микропузырьках.
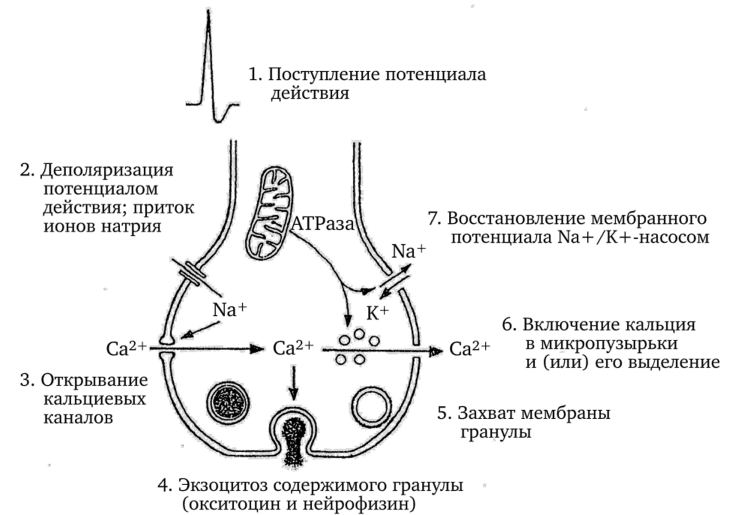
Рис. 3.24. Схема стадий процесса, связывающего стимуляцию с секрецией, в аксонной терминали задней доли гипофиза (по Линкольн, 1987).
и удаляется из терминали. Мембранный потенциал, так же как в других участках клетки, восстанавливается за счет активного транспорта ионов (Линкольн, 1987). Здесь надо отметить, что первоначально существенные разногласия возникли по механизму выведения окситоцина из терминалей с помощью экзоцитоза. Причина заключалась в том, что при электронно-микроскопическом изучении нейрогипофиза животных (Theodosis et al., 1978) и человека (Bergland, Torac, 1969а, b; Seyama et al., 1980a, b, с) данные, подтверждающие движение гранул из терминалей в экстраклеточное пространство, были чрезвычайно редкие или в большинстве случаев отсутствовали. Причина разногласий, согласно Д. Линкольну (1987), заключалась в том, что процесс экзоцитоза является чрезвычайно быстрым, занимающим, вероятно, менее 10 мс. Поэтому даже если искусственно повысить уровень выделения окситоцина до 1% его содержания в нейрогипофизе за минуту, то можно ожидать, что в процесс экзоцитоза вовлекутся лишь однадве гранулы на миллион! В соответствии с обычной методикой электронной микроскопии можно просматривать небольшие участки мембраны терминалей. При этом вероятность обнаружения экзоцитоза гранул незначительна. Более эффективным является использование электронно-микроскопической методики замораживания-скалывания. Благодаря этому методу можно просматривать большие площади мембраны терминалей по сравнению с теми, что выявляются на срезах при обычной электронной микроскопии. Д. Теодозисом с сотрудниками (Theodosis et al., 1978) на нейрогипофизе крыс были проведены исследования с использованием метода замораживания-скалывания и получены многочисленные иллюстрации экзоцитоза.
Таким образом, на каждый потенциал действия, поступивший из сомы в нервную терминаль окситоцинэргической клетки, в кровяное русло выделяется определенное количество окситоцина. Здесь надо отметить, что большая часть нейросекреторных клеток крыс, в которых синтезируется окситоцин, генерирует разряды спонтанных (фоновых) потенциалов действия непрерывно (днем и ночью) со средней частотой 2—4 потенциала действия в секунду. Возможно, с такой частотой генерируется фоновая импульсация и в нейросекреторных окситоцинэргических клетках гипоталамуса человека. Эта частота небольшая, однако она постоянна и поэтому у крыс 9000 клеток, синтезирующих окситоцин, за сутки будут генерировать около 2 млрд потенциалов действия и, соответственно, у женщины 40 000 клеток — около 9 млрд потенциалов действия. Наличие фоновой импульсной активности в нейросекреторных окситоцинэргических клетках предполагает присутствие в крови фоновой (базовой) концентрации окситоцина. Измерение базовой концентрации в крови у лактирующих крыс (Higushi et al., 1986) и женщин (Nissen et al., 1996) показало, что она не превышает 15—20 пкмоль/л. Перерасчет количества окситоцина выделившегося на один спонтанный потенциал действия (Линкольн, 1987) показывает, что это чрезвычайно малая величина и измеряется аттограммами (10″ 18г). Поэтому, несмотря на постоянную генерацию фоновых потенциалов действия, по данным биохимических исследований, потеря окситоцина из задней доли гипофиза у крысы и, вероятно, у женщины в сутки составляет лишь 4% от общего содержания его в нейрогипофизе (Линкольн, 1987).
Наибольший интерес представляет импульсная активность, которая генерируется магноцеллюлярными окситоцинэргическими клетками гипоталамуса в ответ на сенсорную импульсацию, возникающую в нервных волокнах рецепторов ареолярно-сосковой области молочной железы при адекватном раздражении, т. е. при кормлении детеныша (см. рис. 3.20). В связи с этим методика исследования значительно усложняется. Поскольку наряду с регистрацией импульсной активности от магноцеллюлярных окситоцинэргических клеток ядер гипоталамуса необходимо обеспечить одновременное выведение молока детенышем. Исследование рефлекса выведения молока у различных лабораторных животных (Линкольн, 1987) показало, что наилучшей моделью для этих опытов является лактирующая крыса. Оказалось, что молоко у лактирующих крыс крысята могут вывести только тогда, когда крысы спят.
Молоко выделялось также и у анестезированных животных. Причина заключалась в том, что большинство анестезирующих средств способно вызвать состояние мозга крысы, сходное по своему состоянию с медленноволновым сном.
Проведение экспериментов с регистрацией импульсной активности магноцеллюлярных нейронов СОЯ и ПВЯ крысы при адекватном раздражении (выведении молока детенышами) молочной железы дало неожиданные и чрезвычайно важные результаты. Оказалось, что при весьма энергичном воздействии на соски молочных желез детенышами в течение нескольких минут после того, как они были приложены к соскам, активность, регистрируемая от крупноклеточных нейронов, не отличалась от спонтанной активности нейронов крыс, которые не кормили крысят или вообще были не лактирующими (Dreifuss et al., 1981). Однако после 10—15 мин. стимуляции крысятами сосков молочной железы матери, находящейся в состоянии наркоза, импульсная активность увеличивалась в течение 2—4 с взрывоподобным образом с 0—5 с до 30—80 имп/с. Далее следовал период продолжительностью 20—40 с, в течение которого спонтанная импульсация отсутствовала (рис. 3.25, a) (Lincoln, Wakerley, 1975; Линкольн, 1987).
После первого всплеска импульсной активности в среднем через каждые 6 мин. наблюдалась последовательность 2—4 с взрывоподобных повышений частоты потенциалов действия (см. рис. 3.25, а). Одним из главных условий возникновения высокочастотных всплесков импульсной активности в магноцеллюлярных нейронах анестезированных крыс было наличие определенного количества крысят, прикрепленных к соскам. Или, говоря другими словами, суммарная интенсивность адекватного раздражения ареолярно-сосковых областей молочных желез. Так, число нейронов, в которых выявлялось резкое повышение импульсной активности, а также интервал между всплесками активности, не изменялось при увеличении количества крысят, прикрепленных к соскам с 7 до 11. При снижении числа крысят до шести и менее высокочастотные всплески не наблюдались (Lincoln, Wakerley, 1975; Линкольн, 1987). Таким образом, паттерны импульсной активности (см. рис. 3.20), которые возникали в нервных волокнах образующих рецепторы в ареоле молочных желез крысы при выведении молока крысятами не доходили «напрямую» к магноцеллюлярным окситоцинэргическим клеткам СОЯ и ПВЯ. Можно полагать, что импульсная активность, возникающая в нервных волокнах, образующих рецепторы в ареоле и соске молочной железы, поступая по спиноцервикальному пути к нейрональным структурам ГПИА, локализованного в латеральной покрышке среднего мозга (Crowly, 2015), суммируется в течение некоторого времени в нейронах ГПИА. При достижении определенного уровня суммации (вероятно, определенного уровня мембранного потенциала нейронов) нейроны ГПИА синхронно разряжаются на магноцеллюлярные клетки СОЯ и ПВЯ, генерируя всплески импульсной активности (см. рис. 3.25, а). Поскольку каждый потенциал действия.
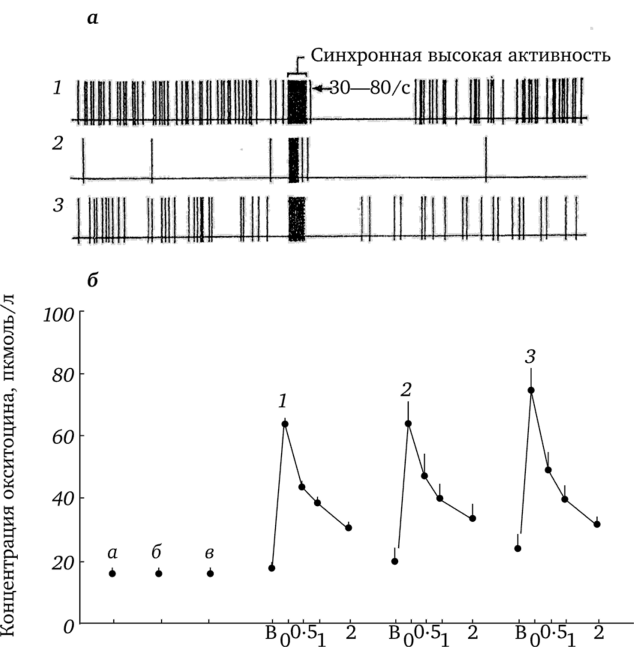
Рис. 3.25. Импульсная активность окситоцинэргических нейронов гипоталамуса (а) и повышение концентрации окситоцина (6) в крови у крыс при кормлении детенышей:
а: 1,2,3 — импульсная активность трех окситоцинпродуцирующих нейронов гипоталамуса крысы (по Линкольн 1987); б — значение концентраций окситоцина у лактирующих крыс (по Higushi et al., 1986): а), б), в) — базальная концентрация окситоцина в крови соответственно перед приложением крысят к соскам, в момент приложения к соскам А—5 крысят и приложения 9—10 крысят; 1,2,3 — пики импульсного повышения концентрации окситоцина в крови у кормящих крыс в случае приложении к соскам 9—10 крысят. По оси абсцисс для всех пиков: В — момент начала рефлекторного повышения окситоцина; 0, 0,5, 1, 2 — концентрация окситоцина соответственно через 30 с интервалами (0, 0,5, 1) и через 2 мин. после начала рефлекторного пика вызывает выброс окситоцина из терминалей задней доли гипофиза, соответственно, во время взрывоподобных увеличениях частоты потенциалов действия количество окситоцина, выходящего в кровоток, также будет импульсно повышаться. Здесь важно отметить, что по приблизительной оценке (Lincoln, Paisley, 1982; Линкольн, 1987), выброс количества окситоцина на один потенциал действия во время высокочастотной генерации импульсной активности существенно повысится и будет измеряться не аттограммами (Ю-18 г), а фемтограммами (10-15 г). Одним из объяснений этого феномена является увеличение длительности потенциалов действия, которые генерируются в нервных терминалях задней доли гипофиза, при увеличении частоты генерации потенциалов действия (Bourque et al., 1990). Увеличение длительности и частоты потенциалов действия будет сопровождаться повышением аккумуляции ионов кальция внутри терминалей и, соответственно, усилением выхода гранул с окситоцином в кровяное русло (Lincoln, Paisley, 1982; Линкольн, 1987). Следует добавить, что в более поздних работах на различных типах секреторных клеток аденогипофиза крысы (лактотрофах, соматотрофах) было продемонстрировано, что при паттернах импульсной активности в виде частотных вспышек экзоцитоз гормонов существенно увеличивается. При этом импульсный выход гормонов был обусловлен импульсным повышением внутриклеточной концентрации ионов кальция (Stojilkovic et al., 2005). Математическое моделирование процесса экзоцитоза (Tagliavini et al., 2016) в секреторных и нейроэндокринных клетках также указывает на преимущество импульсной активности в виде частотных всплесков для экзоцитоза гормонов.
Провести эксперименты с одновременной регистрацией импульсной активности магноцеллюлярных нейронов во время кормления детенышей и измерением концентрации окситоцина в крови кормящих крыс к настоящему времени не удалось. Однако в литературе имеются данные по определению окситоцина в крови крыс с помощью радиоиммунологического метода в процессе кормления детенышей (Higushi et al., 1986) (см. рис. 3.25, б). При определении концентрации окситоцина в объемах крови, которые брались через 30 с во время кормления детенышей, содержание окситоцина в крови импульсно повышалась с 15—20 до 60 —70 пкмоль/л. Длительность пиков была около 2 мин. Причем окситоциновые пики, так же как пики импульсной активности, регистрировались в среднем через 6 мин.
Как уже отмечалось, зарегистрировать электрическую импульсную активность от окситоцинэргических нейронов гипоталамуса женщины по методическим и этическим причинам к настоящему времени, а также в обозримом будущем невозможно. Вместе с тем определение концентрации окситоцина в крови у женщин во время кормления ребенка не составило больших трудностей. Измерения показали, что выход окситоцина в кровь носит импульсный характер. Здесь важно отметить, что импульсный выброс окситоцина наиболее четко выявляется при условии забора образцов крови через 20—30 с (McNeily et al., 1983; Nissen et al., 1996; Jonas et al., 2009) (рис. 3.26, 6).
При интервалах определения окситоцина в крови через 3 мин. и более регистрируется лишь сглаженный повышенный уровень концентрации окситоцина в период кормления ребенка (Weitzman et al., 1980; Dawood et al., 1981; Jhonston, Amico, 1986) (рис.53А). В случае определения окситоцина в крови через промежутки 20—30 с длительность окситоциновых пиков была около 1—1,5 мин., т. е. того же.
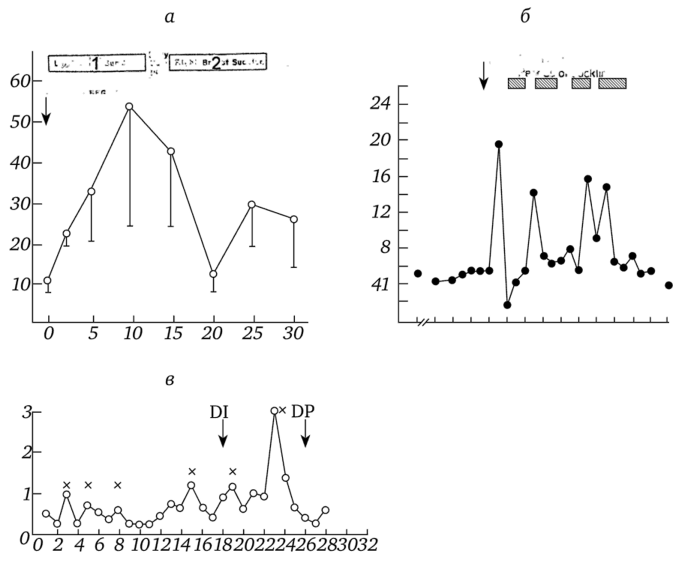
Рис. 3.26. Изменение концентрации окситоцина в крови при кормлении женщиной ребенка (а, б) и во время родов (в):
а — изменение концентрации окситоцина при интервалах забора крови через 3 мин.: I — начало кормления ребенка, 1 — кормление левой грудью, 2 — кормление правой грудью (по Dawood et al., 1981); б — изменение концентрации окситоцина при интервалах забора крови через 25—30 мин.: I — момент первого крика ребенка (по McNeilly et al., 1983); в — изменение концентрации в крови в течение второй и третьей стадии родов: х — окситоциновые пики, DI — рождение ребенка, DP — удаление плаценты.
(по Fuchs et al., 1991).
порядка, что и время окситоциновых пиков у крыс. В связи с этим можно полагать, что окситоциновым пикам у женщин при кормлении ребенка также предшествуют периоды 2—4 с высокочастотной импульсации окситоцинэргических клеток СОЯ и ПВЯ гипоталамуса. Вместе с тем интервал между окситоциновыми пиками у кормящей женщины был короче в два-три раза, чем у лактирующей крысы. Относительно определения пиковых концентраций окситоцина во время кормления ребенка следует указать, что результаты измерений в значительной степени зависят от места забора образцов крови. У лактирующих крыс кровь бралась из большой наружной яремной вены, которая содержит богатую окситоцином венозную кровь, поступающую из задней доли гипофиза. У женщин кровь из задней доли гипофиза также главным образом поступает в яремную вену, которая значительно менее доступна, поэтому чаще всего кровь берут из локтевой вены. Но это означает, что окситоцин, содержащийся в такой крови, уже прошел через легкие и общую систему кровообращения, а следовательно, должен быть разведен и его концентрация уменьшена. Поэтому измеренные средние пиковые концентрации окситоцина у женщин (Nissen et al., 1996) меньше, чем у крыс (Higushi et al., 1986).
Здесь следует отметить, что окситоцин известен уже давно благодаря его способности стимулировать (ускорять) процесс родов, отсюда и его название (греч. oxys — быстрый, tokos — роды). Окситоцин выделяется из нервных окончаний магноцеллюлярных нейронов СОЯ и ПВЯ гипоталамуса женщины в ответ на раздражение главным образом механорецепторов матки во время родов. Уникальные обследования были проведены по измерению динамики концентрации окситоцина в крови у женщины во время родов (Fuchs et al., 1991). Оказалось, что паттерны окситоциновых пиков во вторую и третью стадию родов (см. рис. 3.26, в) имели большое сходство с таковыми у женщин во время кормления грудью ребенка. Это позволяет полагать, что ГПИА является общей нейрональной системой как для импульсной активности, поступающей от рецепторов молочной железы, так и от рецепторов матки.