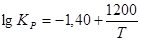Рассмотрим равновесие основной реакции: гидратации — внутримолекулярной дегидратации:
Н2 С=СН2 + Н2 О Н2 СОН — СН3.
Она протекает с выделением тепла, следовательно ее равновесие смещается вправо при понижении температуры. Дегидратации, наоборот, способствует нагревание. Равновесие невыгодно для гидратации олефинов, так как при 150−300о С, когда катализаторы процесса достаточно активны, DGо имеет большую положительную величину и равновесие смещено в сторону дегидратации. При этом для олефинов разного строения различия в термодинамике рассматриваемых реакций незначительны. Как показывает стехиометрия реакций, на их равновесие можно влиять, изменяя давление. Внутримолекулярной дегидратации, идущей с увеличением числа молей веществ, способствует пониженное или обычное давление. Наоборот, гидратации олефинов (в том числе и этилена) благоприятствует высокое давление, увеличивающее равновесную степень конверсии олефина. Так, последняя при 250−300о С и атмосферном давлении составляет всего 0,1−0,2%, что совершенно неприемлемо для практических целей, но при 7−8 Мпа и тех же температурах она возрастает до 12−20%. Зависимость равновесной степени конверсии этилена при его гидратации от давления и температуры изображена на рис. 2, причем аналогичные кривые характерны и для других олефинов. Очевидно, что гидратации способствует одновременное снижение температуры и повышение давления.
Рассмотрим теперь равновесие в системе межмолекулярная дегидратация спиртов — гидролиз простых эфиров:
2ROHROR + Н2 О В случае этанола ее равновесие описывается уравнением.
показывающим, что оно смещается вправо при снижении температуры. Следовательно, при 200−400о С внутрии межмолекулярная дегидратация конкурируют друг с другом. Термодинамическим методом регулирования направления этих реакций является изменение давления: на образование простого эфира оно не влияет, но получению олефина его снижение благоприятствует.
В ряде случаев роль воды более сложная. Так, фосфорная кислота, нанесенная на пористый носитель, образует на его поверхности жидкую пленку, которая абсорбирует воду из газовой фазы. При каждых данных температуре и парциальном давлении водяных паров в газовой фазе устанавливается фазовое равновесие, и фосфорная кислота в пленке имеет определенную концентрацию и соответствующую ей каталитическую активность. Последняя падает при снижении температуры и росте парциального давления воды, что ограничивает выбор этих параметров для каждого случая определенными рамками.