Методы отбора и подготовки почвенных образцов для определения двухвалентного железа в почвах

Выполнение определения. Тщательно перемешивают фильтрат от кремневой кислоты, находящийся в мерной колбе, берут из него пипеткой 10—25 мл и помещают в мерную колбочку емкостью 100 мл. Приливают к взятому раствору 5—10 мл 25%-ного раствора сульфосалициловой кислоты. Количество прибавляемой сульфосалициловой кислоты зависит не только от содержания железа, но и от содержания алюминия, кальция… Читать ещё >
Методы отбора и подготовки почвенных образцов для определения двухвалентного железа в почвах (реферат, курсовая, диплом, контрольная)
Условия отбора проб и доставки их в лабораторию должны исключать возможность окисления двухвалентного железа в период от отбора проб до начала анализа. Пробы почв поступают в лабораторию в герметически закрытых емкостях, например, в металлических стаканах с крышками, залитыми парафином или замазкой. Анализы проводят не позднее одних суток после отбора проб. Хранят пробы в прохладном помещении, при этом должно быть исключено попадание на них прямых солнечных лучей. Точечные пробы на анализ отбирают не менее чем из пяти мест каждого стакана. Масса объединенной пробы — 5 г. При определении в почве двухи трехвалентного железа следует работать со свежевзятыми образцами почвы. Образцы берут в поле в стеклянные банки с притертыми или привинчивающимися пробками так, чтобы банка была полностью заполнена почвой (Аринушкина, 1970, ГОСТ 27 395–87).
Методы определения двухвалентного железа в почвах
Фотометрические методы определения железа.
В связи с тем что и Fe2+ и Fe3+ обладают хромофорными свойствами (электронная конфигурация атома железа — 1s1 2s2 2р6 3s1 Зр63d6 4s2), для фотометрического определения железа используют различные типы химических реакций, которые приводят к образованию окрашенных соединений. Для определения общего содержания железа в почвах разработаны фотометрические методы, основанные на образовании окрашенных соединений как двух-, так и трехвалентного железа. В России наиболее широко используют фотометрический сульфосалицилатный метод определения Fe (III).(Зонн, 1971).
Сульфосалициловая кислота в зависимости от рН раствора образует с Fe (III) три различно окрашенных комплекса. При рН 2—3 образуется красно-фиолетовый комплекс [FeSsal]+, при рН 4−8 коричневато-оранжевый комплекс [Fe (Ssal)2]~ и при рН 8— 10 в аммиачном растворе образуется устойчивый желтый комплекс [Fe (Ssal)3]3-.Красно-фиолетовый комплекс, образующийся в кислой среде, может быть использован для селективного определения Fe (III) в присутствии Fe (II); вариант метода малочувствительный, молярный коэффициент поглощения при длине волны 490 нм равен 2,6*103. Этот комплекс используют при комплексонометри-ческом определении железа в почвах предварительно переведя Fe (II) в Fe (III). Для фотометрического определения валового содержания железа в почвах используют комплекс желтого цвета, устойчивый в щелочной среде. Этот вариант метода позволяет определить общее содержание железа в почвах, так как в условиях эксперимента Fe (II) легко окисляется до Fe (III). Максимум светопоглощения находится в области длин волн 420−430 нм, молярный коэффициент поглощения равен 5,8*1000. Сульфосалициловая кислота образует устойчивые комплексные соединения со многими металлами. При проведении анализа добавляют избыток реагента, чтобы предотвратить осаждение алюминия, магния, кальция при подщелачивании раствора. Комплексы этих элементов с сульфосалициловой кислотой бесцветны. Окрашенные комплексы сульфосалициловая кислота образует с металлами, обладающими хромофорными свойствами.
Фотометрические методы определения железа.
Для предотвращения выпадения в осадок гидроксида Mn (IV) при подщелачивании в раствор предварительно добавляют гидроксиламин.
Валовое содержание железа может быть определено по окрашенному комплексу двухвалентного железа с ортофенантролином (Methodsofsoilanalysis, 1982). В этом случае железо восстанавливают гидроксиламином до двухвалентного состояния. Затем в раствор добавляют ортофенантролин, с которым Fe (II) образует устойчивый, имеющий красноватую окраску, комплекс — Fe (C12H10N2)32+. Эта цветная реакция специфична для Fe2+. Присутствующие в почвах химические элементы, как правило, не влияют на результаты анализа.
Ортофенантролин может быть использован для раздельного определения Fe (II) и Fe (III). В этом случае анализируют две аликвоты исследуемого раствора. В одной из них определяют суммарное содержание Fe (II) и Fe (III) после предварительного восстановления трехвалентного железа, в другой — Fe (II). Определение Fe (II) рекомендуется проводить в темноте или при слабом красном свете, чтобы предотвратить фоторедукцию комплекса Fe (HI) с ортофенантролином. Окрашенный комплекс Fe (II) с ортофенантролином образуется сразу после добавления реагента и устойчив в течение нескольких суток. Окраска развивается в интервале значений рН от 2 до 9. Однако при проведении анализа почв оптическую плотность измеряют при рН 3−5, так как при высоком содержании кальция и фосфора в условиях меньшей кислотности может произойти образование труднорастворимого фосфата кальция.
Определение железа сульфосалицинатным методом.
В мерную колбу вместимостью 100 мл помещают 10—25 мл фильтрата, полученного после отделения кремниевой кислоты. В колбу добавляют 0,5 г гидроксиламина, приливают 5−10 мл 25%-ного раствора сульфосалициловой кислоты. Раствор в колбе перемешивают и приливают аммиак до появления слабого запаха. Раствор снова перемешивают и добавляют еще 2 мл аммиака. Объем жидкости в колбе доводят водой до метки, раствор тщательно перемешивают и через 10 мин измеряют оптическую плотностьДля построения калибровочного графика в мерные колбы вместимостью 100 мл помещают 1, 2, 4, 5, 7 мл стандартного раствора с содержанием Fe 0,1 мг/мл. В колбы приливают 25 мл воды и проводят анализ, как указано выше, для испытуемых растворов.
Строят график зависимости оптической плотности от концентрации Fe2O3 и находят содержание железа в почве.(Зонн, 1978, Рукака, 1978).
Реагенты:25%-ный раствор сульфосалициловой кислоты. Навеску сульфосалициловой кислоты массой 25 г растворяют в 100 мл дистиллированной воды. Раствор хранят в темной склянке с притертой пробкой.25%-ный раствор аммиака, не содержащий CO2.Гидроксиламин солянокислый NH2OH HCl.
Стандартный раствор железа. Навеску [(NH4)2SO4 Fe2(SO4)3*24H2O) массой 0,8637 г растворяют в 1 л 5%-ного раствора H2SO4 и тщательно перемешивают. Полученный раствор должен содержать в 1 мл 0,1 мг железа. Концентрацию железа в растворе проверяют гравиметрическим методом. Стандартный раствор железа может быть получен растворением 0,1000 г металлического железа в 5%-ном растворе серной кислоты. Если для полного растворения железа необходимо, раствор подогревают.
Комплексонометрическое определение железа в почвах.
Определение общего содержания железа в почвах комплексонометрическим методом проводят титруя ионы трехвалентного железа. Комплексонат трехвалентного железа более устойчив, чем железа двухвалентного. Поэтому перед титрованием Fe (II) окисляют азотной кислотой при нагревании. В связи с тем что Fe (III) легко гидролизуется, его комплексонометрическое титрование можно проводить лишь в сильнокислой среде. Трехвалентное железо может быть оттитровано даже при рН 1, константа устойчивости комплексоната трехвалентного железа в этом случае равна 107,1. При титровании в сильнокислой среде устраняется мешающее влияние многих сопутствующих элементов, которые в этих условиях либо вовсе не образуют комплексонатов (Ba, Mg, Ca), либо ком-плексонаты образуются, но они малоустойчивы. Относительно устойчивые комплексонаты в сильно кислой среде образуют Bi3+, V3+, но их содержание в почвах невелико и влиянием этих элементов на результаты определения железа в почвах пренебрегают. Титан при высоких содержаниях в почвах может влиять на результаты определения валового содержания железа. В связи с тем что железо медленно реагирует с комплексном III, титруют подогретые растворы.
В качестве индикатора используют сульфосалициловую кислоту. Интервал рН, в котором развивается красно-фиолетовая окраска сульфосалицилатного комплекса железа, не велик. Поэтому нужно очень строго соблюдать предписанные методикой условия проведения анализа. В противном случае окрашенное соединение может не образоваться. Часто раствор не приобретает красно-фиолетовой окраски в связи с тем, что имеет более кислую, чем необходимо, реакцию.
В этом случае в анализируемую систему нужно добавить раствор аммиака, а не сульфосалициловой кислоты.
В конечной точке титрования сульфосалицилат железа разрушается вследствие образования более устойчивого комплексонатажелеза и лиловая окраска исчезает, переходя в лимонножелтую, обусловленную комплексонатом железа. Как уже отмечалось, молярный коэффициент поглощения сульфосалицилата железа невелик, поэтому переход окраски при комплексонометрическом титровании железа нерезкий.(Зонн, 1978, Рукака, 1978).
Колориметрическое определение железа сульфосалицыловым методом.
Сульфосалициловая кислота образует с железом комплексные ионы разной окраски: при рН 2—2,5 [Fe (Sal)]+ красного цвета, при рН 4—8 [Fe (Sal)г]- бурого цвета и при рН 8—11,5 Fe (SaI2)]3—желтого цвета149. В кислой среде указанные комплексные ионы образует только окисное железо, в щелочной — окисное и закисное, поскольку в этих условиях Fe2+легко окисляется до Fe3+.Таким образом, аммиачным вариантом сульфосалицилового метода определяют общее содержание железа, т. е. сумму ионов Fe2+ + Fe3+.
Аммиачный вариант сульфосалицилового метода основан на образовании внутрикомплексного железосульфосалицилатного иона:
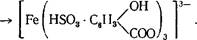
Желтая окраска этого комплексного иона отличается настолько большой устойчивостью, что окрашенный раствор трисульфосалицилата железа не изменяет своей окраски в течение месяца и более.
Сульфосалициловый метод позволяет применять все способы колориметрирования как визуального, так и фотоэлектроколори-метрирования. Молярный коэффициент погашения окрашенного раствора трисульфосалицилатного комплекса е = 6000 при л = 430нм. Закон Бера соблюдается до концентрации 4 мгFe3+1л. (Зонн, 1978, Рукака, 1978).
Выполнение определения. Тщательно перемешивают фильтрат от кремневой кислоты, находящийся в мерной колбе, берут из него пипеткой 10—25 мл и помещают в мерную колбочку емкостью 100 мл. Приливают к взятому раствору 5—10 мл 25%-ного раствора сульфосалициловой кислоты. Количество прибавляемой сульфосалициловой кислоты зависит не только от содержания железа, но и от содержания алюминия, кальция и магния, так как часть реактива расходуется на связывание указанных ионов в бесцветные комплексы. Поэтому сульфосалициловую кислоту прибавляют в таком количестве, чтобы после нейтрализации кислоты аммиаком не было помутнения раствора от выпавших гидроокисей. В колбочку прибавляют 25%-ный раствор аммиака до появления слабого запаха. По мере нейтрализации солянокислого раствора, появившаяся красно-фиолетовая окраска переходит в желтую.
Окрашивание раствора происходит в интервале рН 1 —12. В сильнокислой среде (рН12 окрашивание тоже не наблюдается. В этом случае выделяется гидроокись Fe (OH)3.
В случае помутнения в раствор вносят еще некоторое количество сульфосалициловой кислоты—до полного просветления раствора, после чего добавляют аммиак до сильного запаха. Добавляют еще 1 мл 25%-ного раствора аммиака, чтобы реакция была явно щелочной. Избыток аммиака не вредит определению, но аммиак должен быть свободен от С02. В противном случае раствор может стать мутным от СаС03 и MgCCb.
Если окраска раствора не чисто желтая, а имеет буроватый или коричневато-буроватый оттенок, определение следует повторить с новой порцией анализируемого раствора, в который вносят 0,5—1 г солянокислого гндроксиламина или гидразина, чтобы удержать марганец в растворе, т. е. воспрепятствовать выделению осадка гидрата двуокиси марганца. Такой осадок выделяется спустя некоторое время после окрашивания раствора, поэтому фотометрирование рекомендуется проводить в первые 5—10 мин после прибавления всех реактивов.
Доводят раствор в колбе дистиллированной водой до метки, перемешивают и проводят колориметрическое определение тем или другим способом.
Определение двухвалентного железа в почве по ГОСТу.
Двухвалентное железо определяют колориметрически с бб-дипиридилом. В мерную колбу на 100 мл помещают 10−20 мл вытяжки, 1 мл 10%-ного раствора NaF и 1 мл 10%-ного раствора Н3ВO3, прибавляют.
1 капли индикатора тимолблау и приливают буферный раствор (уксусная кислота+уксуснокислый натрий) до перехода окраски индикатора в желтый цвет. Приливают 1 мл раствора бб-дипиридила, перемешивают, доводят водой до метки и снова перемешивают. Оставляют стоять на 30 мин., после чего фотоколориметрируют. Окраска раствора при стоянии в темноте не изменяется в течение многих дней.
Для приготовления стандартной шкалы в мерные колбы на 100 мл вносят 5−10 мл образцового раствора (с интервалом в 1 мл), содержащего в 1 мл 0,02 мг FeO.
Приливают те же реактивы, как и в случае испытуемых растворов. Фотоколориметрируют по истечении 30 мин. Реактивы. 1. 1,0 н. раствор серной кислоты. 28 мл крепкой серной кислоты (уд.вес 1,84) вливают в дистиллированную воду и доводят объем до 1 л. 2. 0,05 н. раствор трилона Б. 9,3 г трилона Б растворяют в дистиллированной воде, доводя объем до 1 л. Титр трилона устанавливают, но раствору железа с известным содержанием железа.
- 2. 10%-ный раствор сульфосалициловой кислоты. 10 г сульфосалициловой кислоты растворяют в воде, доводя объем до 100 мл.
- 3. Раствор бб-дипиридила. 5 г бб-дипиридила растворяют в дистиллированной воде, к которой прибавлено 5−8 мл 0,1 н. НСl. Объем раствора доводят до 1 л дистиллированной водой.
- 4. Индикатор тимолблау. Готовят 0,04%-ный спиртовой раствор.
- 5. Буферный раствор. Смешивают 100 мл 2%-ной уксусной кислоты с 100 мл 3%-ного уксуснокислого натрия.
- 6. Образцовый раствор железа. Навеску в 0,5462 г перекристаллизованной соли Мора FeSO4(NH4)2SO4 * 6Н2O помещают в мерную колбу на 1 л, растворяют в прокипяченной воде, подкисленной 10−15 мл 10%-ной H2SO4, и доводят до метки дистиллированной водой. В 1 мл этого раствора содержится 0,1 мг FeO. Из приготовленного таким образом раствора готовят рабочий раствор, содержащий в 1 мл 0.02 мг FeO.
- (ГОСТ 27 395−87).