Термодинамические процессы идеальных газов

Понятие политропного процесса было введено в термодинамике по аналогии с понятием об адиабатных процессах, которое было введено раньше. Уравнение политропного процесса (2.124) по внешнему виду сходно с уравнением адиабаты pх k = const; однако существенная разница между этими уравнениями состоит в том, что если показатель адиабаты (изоэнтропы) k является в общем случае величиной переменной, то уже… Читать ещё >
Термодинамические процессы идеальных газов (реферат, курсовая, диплом, контрольная)
Термодинамическим процессом называется последовательное и взаимосвязанное изменение состояния термодинамической системы в результате её взаимодействия с окружающей средой. Исследование термодинамических процессов идеальных газов Идеальный газ в действительности не существует — это модель газа. Использование в термодинамике понятия идеального газа, с одной стороны, упрощает изучение процессов, а с другой стороны, даёт результаты близкие реальному газу, взятому при малых давлениях. ставит своей целью разработать методы расчёта параметров состояния системы в процессе, а также теплоты и работы процесса.
Изучение работы тепловых машин показывает, что наибольший интерес для практики представляют некоторые частные случаи, когда значение одного из параметров остаётся постоянным. Такие процессы называются изопроцессами. К ним относятся изохорный (х=const), изобарный (p=const), изотермный (T=const) и изоэнтропный (s=const). Наряду с изопроцессами рассматриваются политропные процессы, которые являются, с одной стороны, обобщением изопроцессов идеальных газов, а с другой стороны, они сами могут рассматриваться как разновидность изопроцессов, так как для них постоянны работоёмкость CW и показатель политропы n.
Изохорный процесс. В изохорном процессе выполняется условие dх=0, или х=const. Такой процесс совершается рабочим телом (газом), находящимся в цилиндре, при неподвижном поршне, если к рабочему телу подводится теплота q1−2 от источника тепла (хаотического движения) или отводится теплота q1−3 в окружающую среду (см. рис. 2.8, а).
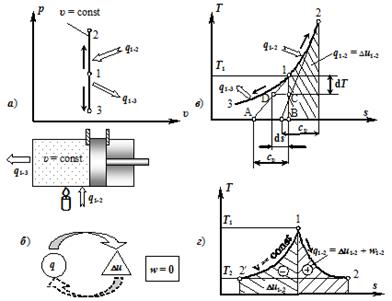
Рисунок 2.8 — Изохорный процесс х = const.
Уравнение изохорного процесса может быть получено из уравнения состояния идеального газа pх = RT, если принять х = const. В этом случае p /T = R / х = const, или.
p2 /p1 = T2 /T1, (2.98).
т. е. в изохорном процессе давление газа пропорционально температуре.
Удельная работа изменения объёма (деформации) газа, определяемая выражением (2.16), в случае изохорного процесса равна нулю w = pdх = 0, так как в изохорном процессе dх = 0, т. е. работа изменения объёма не совершается.
В случае изохорного процесса элементарная удельная теплота в соответствии с (2.66) определится выражением.
q = qх = cхdT, (2.99).
а удельная теплота конечного процесса 1−2 при cх = const.
q1−2 = cх (T2 — T1). (2.100).
Поскольку работа в изохорном процессе равна нулю, то в соответствии с ПЗТ (2.23) теплота равна изменению внутренней энергии.
du = qх = cх dT (2.101).
Изобарный процесс. В изобарном процессе выполняется условие dp = 0, или p = const. Такой термодинамический процесс может протекать в цилиндре с подвижным поршнем, когда в соответствии с выражением (1.35) произведение концентрации частиц на температуру остаётся постоянным: NV Т = const.
Уравнение изобарного процесса может быть получено из уравнения состояния идеального газа pх = RT, если принять p = const. В этом случае х/T = R/p = const, или х2 /х1 = T2 /T1, (2.102).
т. е. в изобарном процессе объём газа пропорционален его температуре.
Удельная работа в изобарном процессе определяется интегрированием общего выражения для работы изменения объема (объёмной деформации) (2.18) при p = const:
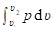
w = = p (х2 — х1). (2.103).
На хp-диаграмме работа газа изображается в виде площади под горизонтальной линией процесса 1−2 (рис. 2.9, a), причём w > 0, если х2 > х1.
Так как pх1 = RT1 и pх2 = RT2, то в соответствии с (2.38).
wp = R (T2 — T1) = сwр (T2 — T1), (2.104).
где сwр = wp / ?T = R — удельная изобарная работоёмкость (изменения объёма).
Следовательно, удельная газовая постоянная равна удельной изобарной работоёмкости, которая в свою очередь численно равна удельной работе, совершаемой при изменении температуры на один градус в изобарном процессе.
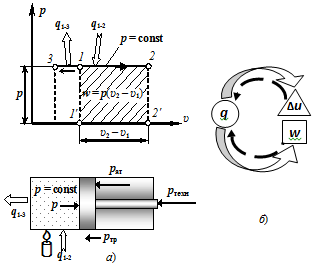
Рисунок 2.9 — Изобарный процесс р = const в хр-диаграмме Как следует из выражения (2.91), работа газа в изобарном процессе положительна только в том случае, если температура газа увеличивается, а это имеет место при процессе расширения только в случае нагрева газа.
В случае изобарного процесса элементарная удельная теплота изобарного процесса определится выражением.
q = qp = cp dT, (2.105).
а полная удельная теплота изобарного процесса 1−2 в случае постоянной теплоёмкости.
q1−2 = qp = cp (T2 — T1). (2.106).
Приращение удельной энтальпии газа в изобарном процессе в соответствии с ПЗТ (2.70) равно теплоте процесса,.
dh = qp = cp dT (2.107).
и, следовательно, при cp = const.
qp = cp (T2 — T1) = h2 — h1. (2.108).
Уравнение ПЗТ (2.86) сохраняет свой вид.
q1−2 = u1−2 + pdх, (2.109).
то есть в процессе расширения 1−2 подводимая теплота равняется увеличению ВЭ и совершённой работе изменения объёма (в этом соотношении все величины положительны).
Преобразование движения (энергии) в процессах изобарного расширения и сжатия газа иллюстрируется схемой на рисунке 4.9, б.
Изотермный процесс. При изотермном (изотермическом) процессе выполняется условие dT = 0, или T = const. Такой термодинамический процесс протекает, например, в цилиндре поршневой машины, когда по мере подвода тепла к рабочему телу поршень перемещается, увеличивая объём настолько, что температура остаётся неизменной.
Уравнение изотермического процесса может быть получено из уравнения состояния, если принять T = const. В этом случае.
pх = RT = const. (2.110).
Следовательно, на хp-диаграмме изотерма является равнобокой гиперболой (рис. 2.11 a). Из уравнения изотермы (2.98) следует.
p2 / p1 = х1 / х2, (2.111).
т. е. при постоянной температуре давление и объём рабочего тела обратно пропорциональны. Отношение (2.149) является следствием закона Бойля-Мариотта.
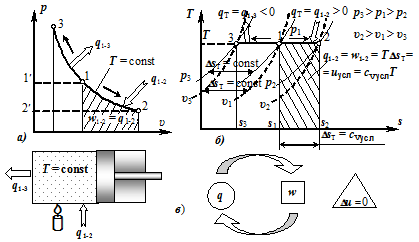
Рисунок 2.11 — Изотермный процесс T = const.
Поскольку внутренняя энергия и энтальпия идеального газа зависят только от температуры, то изотермный процесс идеального газа является одновременно и процессом при постоянной внутренней энергии (duT = 0) и при постоянной энтальпии (dhT = 0): uид = const; hид = const.
Применительно к изотермному процессу идеального газа уравнение ПЗТ (2.96) принимает для удельных величин вид q = w = pdх. Из данного выражения видно, что в изотермическом процессе теплота равна работе изменения объёма (рис. 2.11, в). То есть движение, подводимое к рабочему телу в хаотической форме в процессе теплообмена в количестве q, отводится в упорядоченной форме в процессе совершения работы в том же количестве (w = q), в результате чего запас хаотического (теплового) движения в системе не изменяется. О чём свидетельствует как неизменность температуры, характеризующей интенсивность движения отдельных молекул, так и неизменность внутренней энергии, характеризующей интенсивность хаотического движения всех молекул идеального газа.
Удельная работа в изотермном процессе определяется интегрированием общего выражения для работы изменения объёма путём перехода к одной переменной (х) с помощью уравнения состояния p = RT / х.
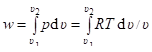
= RT ln (х2 / х1).
С учётом выражения (4.149) для изотермного процесса получим:
qТ = wТ = p1 х1 ln (х2 / х1) = p1 х1 ln (p1 / p2); (2.112).
qТ = wТ = RT ln (х2 / х1) = RT ln (p1 / p2). (2.113).
На sT-диаграмме изотермный процесс изображается горизонтальной прямой (T = const). Площадь под процессом (рис. 2.11, б) соответствует теплоте q и работе w.
qТ = wТ = T (s2 — s1). (2.114).
Адиабатный процесс. Адиабатным (от греч. adiabatos — непереходимый) процессом (термин «адиабатный процесс» был введён Ренкиным) называется процесс, происходящий на всём своём протяжении без теплообмена с окружающей средой, т. е. когда элементарная внешняя теплота для любой точки процесса равна нулю: qе = 0. При таком определении адиабатного процесса следует различать адиабатный процесс без трения (qе = qтр = 0) — идеальный (обратимый) адиабатный процесс и с трением (qе = 0, qтр? 0) — реальный адиабатный процесс.
В курсах термодинамики, как правило, рассматривается идеальный адиабатный процесс (без трения), что специально не оговаривается. Это приводит к определённым трудностям при рассмотрении реальных процессов, например, при рассмотрении истечения через короткий насадок с трением. Адиабатный процесс возможен, если стенки покрыты идеальной тепловой изоляцией — адиабатной оболочкой. Адиабатных оболочек, полностью теплоизолирующих тела, не существует. Приближённо можно считать адиабатным процесс, протекающий и в нетеплоизолированной системе, если он осуществляется столь быстро, что теплообмен между системой и ОС практически не успевает происходить (например, при распространении звука в газе, истечении газа из ресивера через короткий насадок).
Идеальный (без трения) адиабатный (изоэнтропный) процесс. Адиабатный процесс, протекающий без трения, называется идеальным адиабатным, обратимым адиабатным или изоэнтропным (s = const) процессом. В таком процессе отсутствует внешний теплообмен qe = 0 (необходимое условие адиабатности процесса) и нет теплоты трения qтр = wтр = 0 — условие идеальности, или обратимости процесса.
Уравнения ПЗТ (2.88) и (2.86) для изоэнтропного процесса запишутся в виде:
qs = dhs — хdps = Tds = 0, или dhs = хdps;
qs = dus + pdхs = Tds = 0, или dus = - pdхs.
Решая совместно эти уравнения, получим.
dhs /dus = (?h /?u)s = - хdps / (pdхs) = - (х/p)(?p /?х)s = k, (2.115).

где k = (?h /?u)s = (2.116).
— показатель адиабаты (изоэнтропы) для любого вещества (идеального или реального газа, жидкости, твёрдого тела).
Для идеального газа внутренняя энергия и энтальпия зависят только от температуры (u = cхT, h = cpT), то уравнение (2.104) для показателя изоэнтропы k приобретает вид.
k = kид = dh / du = cp dT / (cх dT) = cp / cх (2.117).
Разделяя переменные х и р в (2.104), получим уравнение идеального адиабатного процесса в дифференциальном виде (индекс s опускаем, т. к. получаем уравнение именно для изоэнтропного процесса).
dp /p + k dх/х = 0, (2.118).
а интегрируя — в интегральном виде.
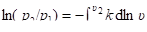
. (2.119).
Если в рассматриваемом интервале изменения состояния системы (между точками 1 и 2) показатель изоэнтропы k остаётся неизменным, то из (4.158) получим уравнение адиабаты (адиабаты Пуассона), справедливое и для реального газа,.
p1х1k = p2х2k, или pхk = const (2.120).
Для изоэнтропного процесса в идеальном газе из уравнения (2.99 можно получить соотношения, связывающие между собой значения Т и х, а также Т и р на изоэнтропе, путём подстановки в (2.99) соответственно р = RT/х и х =RT/р:
T1 х1k —1 = T2 х2k —1; (2.121).
p2 /p1 = (T2 / T1) k / (k — 1) или T2 /T1 = (p2 /p1) (k — 1)/k, (2.122).
где k — показатель изоэнтропы, постоянный в интервале состояний между точками 1 и 2; если же k переменно в данном интервале параметров состояния, то в этих уравнениях должна фигурировать величина kср — средняя в этом интервале параметров.
На рисунке 2.12, а изоэнтропный процесс 1−2s изображается сплошной линией. На sT-диаграмме изоэнтропный процесс изображается вертикальной линией s = const (рис. 2.12, б), причём падение температуры происходит при расширении рабочего тела, а увеличение температуры — при его сжатии.
При qе = qтр = 0 уравнение ПЗТ (2.126) принимает вид.
w = pdх = - du. (2.123).
Следовательно, работа в идеальном адиабатном процессе совершается только за счёт уменьшения внутренней энергии.
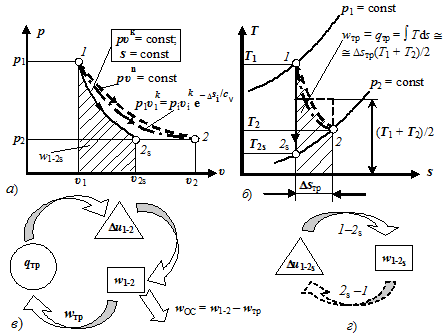
Рисунок 2.12 — Адиабатный процесс (1−2s — изоэнтропный и 1−2 — реальный) Проинтегрировав выражение (2.112) при cх = R /(k — 1) = const, имеем.
w1−2s=u1-u2=cх (T1 — T2) = [R /(k — 1)] T1 (1 — T2/ T1) = cwад (T2 — T1), (2.124).
где cwад = wад / ДT = - cх = - R /(k — 1) (2.125).
— удельная адиабатная работоёмкость.
После замены RT1 = p1х1 в (2.123) и с учётом (2.121) выражение для удельной работы изменения объёма в изоэнтропном процессе принимает вид.
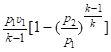
w1−2s =. (2.126).
Выражение c = q/dT = 0/dT показывает, что теплоёмкость идеального адиабатного (изоэнтропного) процесса равна нулю. Об этом же свидетельствует изоэнтропный процесс 1−2s в диаграмме s-T (см. рис. 2.12, б), так как подкасательная к нему, дающая представление о теплоёмкости, также равна нулю.
Политропный процесс. Своё название «политропный процесс» получил от сочетания греческих слов: «поли» — много, «тропос» — путь — «многопутный процесс», или «обобщающий процесс». Политропные процессы оказались удобными для аппроксимации действительных газовых процессов в двигателях внутреннего сгорания и компрессорах, в которых процессы сжатия и расширения занимают промежуточное положение между изотермическими и адиабатными процессами и, следовательно, не могут быть аппроксимированы известными изопроцессами.
Политропными процессами называются процессы, при протекании которых совершается одна и та же работа изменения объёма при изменении температуры на один градус, т. е. выполняется условие постоянства работоёмкости.
сw = pdх / dT = const. (2.127).
Используя уравнение ПЗТ (2.126), условие политропности процесса (2.124) можно записать в таком виде:
сw = pdх / dT = (qn — du) / dT= cn — cv = const, (2.128).
где cn = qn / dT — теплоёмкость политропного процесса.
Согласно этому соотношению разность между переменными теплоёмкостями политропного cn и изохорного cv процессов есть величина постоянная.
Уравнение политропного процесса имеет вид.
pх n = const или p1х1n = p2х2n. (2.129).
Термодинамические процессы, удовлетворяющие уравнению (2.124), называются политропными процессами. Постоянную величину n, имеющую любое постоянное значение в интервале от минус до плюс, принято называть показателем политропного процесса или коротко показателем политропы n.
Понятие политропного процесса было введено в термодинамике по аналогии с понятием об адиабатных процессах, которое было введено раньше. Уравнение политропного процесса (2.124) по внешнему виду сходно с уравнением адиабаты pх k = const; однако существенная разница между этими уравнениями состоит в том, что если показатель адиабаты (изоэнтропы) k является в общем случае величиной переменной, то уже само понятие политропного процесса основано на предположении о том, что показатель политропы n является постоянной величиной.
Решая (2.124) совместно с уравнением состояния Клапейрона, получим.
T1 х1n -1 = T2 х2n -1; (2.130).
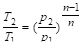
. (2.131).
Теплоёмкость политропного процесса можно выразить через показатель политропы n:
(2.132).

где k = cp /cv.
Поскольку политропный процесс является обобщением для изопроцессов, то уравнения этих процессов и теплоёмкости их можно найти, подставив в уравнения политропного процесса (2.124) и теплоёмкости (2.131) соответствующие значения показателя политропы n. В таблице 2.2 представлены уравнения изопроцессов и их теплоёмкостей в зависимости от показателя политропы n.
Таблица 2.2 — Изопроцессы и их теплоёмкости.
Процесс. | |||
Изопроцесс. | Политропный. | ||
n. | pхn = const хp1/n = const. | ||
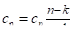 Изобарный. | p = const. | cр = cv k. | |
Изотермический. | pх = const. | cТ = ± ? | |
Адиабатный (изоэнтропный). | k. | pхk = const. | cs = 0. |
Изохорный. | ± ? | х = const. | cх. |
Значение показателя политропы n определяет расположение и характер линии политропного процесса на хp-диаграмме (рис. 2.14, а). Если выбрать некоторую произвольную точку, А и провести через неё изопроцессы как в сторону расширения, так и сжатия, то всё поле построенной таким образом диаграммы разделится на области, каждая из которых объединяет все располагающиеся в её пределах термодинамические процессы общностью определенных свойств.
Рисунок 2.14 — Политропные процессы Все процессы, исходящие из точки, А и располагающиеся левее изохоры n =? имеют отрицательную работу, так как сопровождаются сжатием рабочего тела. Процессы справа от изохоры сопровождаются расширением рабочего тела и поэтому совершают положительную работу; на самой изохоре работа равна нулю.
Процессы, начинающиеся в точке, А и располагающиеся правее и выше изоэнтропы (n = k = = const), протекают с подводом тепла, а ниже и левее — с отводом тепла; на самой изоэнтропе теплообмен не происходит и теплота процесса равна нулю.
Все процессы справа и выше изотермы n = 1 протекают с повышением температуры рабочего тела, а слева — с понижением; на самой изотерме dT = 0.
Процессы, протекающие между изоэнтропой и изотермой в верхней части диаграммы, происходят с увеличением температуры и отводом тепла (q 0) и уменьшением температуры (dT < 0); в результате теплоёмкость для этих процессов отрицательна.
На рисунке 2.14 б показаны те же термодинамические процессы, что и на рисунке 2.14, а. Все термодинамические процессы, начинающиеся в точке А, с увеличением энтропии протекают с подводом тепла извне. В областях, расположенных левее изоэнтропы, процессы, начинающиеся в точке А, протекают с уменьшением энтропии, т. е. с отводом тепла от рабочего тела.
Теплота процесса q изображается в виде площади под кривой процесса 1−2. Так как энтропия в выбранном политропном процессе уменьшается, то теплота от рабочего тела отводится, т. е. q < 0.