Получение рекомбинантных ДНК

Именно благодаря открытию этих ферментов стало возможно развитие генной инженерии. Они являются элементом системы рестрикции — модификации, предназначенной для защиты собственной ДНК клетки от включения в нее чужеродного генетического материала. В результате их открытия появилась уникальная возможность получать фрагменты ДНК с одинаковыми концами известного строения, что позволило использовать… Читать ещё >
Получение рекомбинантных ДНК (реферат, курсовая, диплом, контрольная)
Методы введения ДНК в бактериальные клетки разнообразны. Схематично получение рекомбинантных ДНК можно представить в следующей последовательности.
Источник генов: Векторы:
- 1)фрагмент генома 1) плазмиды
- 2)синтез м-ДНК на РНК 2) фаги
При помощи ревертазы 3) космиды.
- 3) химический синтез
- 1Создание рекомбинантных молекул:
- 1) соединение и легирование
- 2) легирование тупых концов
- 3) использование линкеров
- 4) пришивание гомополимер
II Введение в клетку хозяина:
- 1) трансформация
- 2) трансфекция
- 3) трансдукция
III Выделение клеток, содержащих выделенный ген:
- 1) комплементация
- 2) иммунологические методы
- 3) гибридизация нуклеиновых кислот
На рис. выделено 3 основных этапа: получение участков ДНК, содержащих информацию для синтеза целевого полипептида (рекомбинантных молекул); введение полученной ДНК в клетку хозяина, как правило, это замкнутая кольцевая ДНК, содержащая репликатор. И, наконец, синтез необходимого продукта как следствие функционирования клеток хозяина, содержащих включенный ген.
Подобного рода работы осуществляются с культурами Bacillus subtilis, Escherichia coli, Saccharomyces cerevisiae и др.
Ранее упоминалось, что клетки микроорганизмов используются для синтеза гормонов, стимуляторов иммунитета и др. В 1996 г. клонирован, частично секвенирован и экспрессирован в дрожжах Saccharomyces cerevisiae ген а-амилазы Saccharomyces fibuligera. При сравнении с ранее клонированным геном в первичной структуре белка обнаружены 4 аминокислотные замены. Получены данные об эффективной экспрессии гена а-амилазы Saccharomyces fibuligera под контролем собственного промотора. Показано, что нативный сигнальный пептид обеспечивал секрецию фермента в клетках Saccharomyces cerevisiae, при этом эффективность секреции а-амилазы составляла 98%. Существует два метода введения ДНК в бактериальные клетки: применение плазмид в качестве вектора и умеренных бактериофагов.
Как упоминалось в главе «Разделы и объекты биотехнологии», плазмиды представляют собой кольцевые молекулярные ДНК, соответствующие по размеру 1—3% генома бактериальной клетки. Они детерминируют признаки, которые сама бактериальная хромосома обычно не кодирует. Например, они содержат информацию, необходимую для конъюгации бактериальных клеток, обусловливают ряд заболеваний растений и животных. Они позволяют клеткам использовать многие сложные соединения в качестве источников питания и обеспечивают устойчивость к различным токсичным агентам, особенно антибиотикам.
Плазмиды стафилококков, например, несут гены устойчивости к пенициллину, соединениям ртути и ряда тяжелых металлов, вызывающих летальный исход. Наличием плазмид обусловлены некоторые заболевания с выраженной диареей, стафилококковой импедиго, створаживание молока и превращение его в сыр молочнокислыми бактериями, а также разнообразные биохимические реакции, характерные для бактерий рода Pseudomonos. Плазмиды могут управлять синтезом инсектицида в клетках Bacillus thuringiensis. Использование плазмид в генной инженерии, начиная с 1975 г., послужило толчком для исследования их структуры и характера репликации.
Количество плазмид в клетке зависит от их размера (от одной до сотни): чем крупнее плазмида, тем меньше количество ее копий. Присущая самой плазмиде регуляторная система ее воспроизводства была описана в 1972 г. датчанином Нордстремом. Количество копий определяется белками, которые подавляют репликацию. Сегмент ДНК длиной не более двух тысяч пар нуклеотидов управляет репликацией плазмиды, которая более чем в 50 раз ее крупнее. Нестабильность значительной части генетических признаков, причем не только у бактерий, но и у высших организмов, объясняется тем, что эти признаки определяются плазмидами и другими генетическими системами. Плазмиды способны к выживанию независимо от клетки, в которой они обнаружены; снабжают клетки дополнительными адаптивными функциями за счет способности включать в себя новые гены, а уже затем «перетасовывают» их так, что это не влияет на эффективность репликации самих плазмид, а также наделяют клетку запасом генетической информации, которую гены используют по мере необходимости.
Метод использования бактериофага, содержащего 10—15 генов, основан на том, что в его геном встраивают нужный ген, который реплицируется вместе с генами вируса при размножении последнего в «клетке-хозяине».
В обоих случаях при введении ДНК в бактериальные клетки используют ферменты — специфические эндонуклеазы или рестриктазы:
Именно благодаря открытию этих ферментов стало возможно развитие генной инженерии. Они являются элементом системы рестрикции — модификации, предназначенной для защиты собственной ДНК клетки от включения в нее чужеродного генетического материала. В результате их открытия появилась уникальная возможность получать фрагменты ДНК с одинаковыми концами известного строения, что позволило использовать рестрикционные эндонуклеазы в качестве основного «инструмента» в разнообразных генно-инженерных экспериментах. Ферментативная система рестрикции и модификации ДНК была открыта в 1953 г. С. Луриа, Г. Бертани и Дж. Уэглом при изучении специфичности фагов, т. е. эффективности посева фагов при смене хозяев. К 1976 г. было обнаружено более 40 рестриктаз, в том числе для 23 были определены последовательности узнавания нуклеотидов. В настоящее время системы рестрикции — модификации найдены практически у всех исследованных бактерий. Выделение большого количества рестриктаз позволило систематизировать и разработать номенклатуру рестриктаз и изучить их свойства. Впервые номенклатура рестриктаз была предложена в 1977 г. Г. Смитом и Д. Натансоном. В соответствии с этой номенклатурой все ферменты этой группы подчиняются следующим правилам.
Фермент системы обозначают буквами: первая буква означает назначение рода, вторая и третья — первые буквы названия вида организма, из которого выделен данный фермент. Например, Есо — рестриктаза выделена из Escherichia coli. Для сокращенного обозначения рестриктаз перед названием фермента ставится буква R, а для обозначения модифицирующих метилаз — буква М, например: REco и МЕсо.
За родовидовым названием следует типовая характеристика штамма: например, Hind означает, что данный фермент получен из клеток Haemophilus intluenzae с серотипом d, либо буквенное обозначение штамма источника фермента или музейный номер культуры, например ЕсоК, EcoB, Bsu 1076, Bsu 1114, Bsu 1247.
Если один штамм содержит несколько разных систем, то ферменты этих систем обозначают римскими цифрами: например, Hael, Haell, Haelll относятся к трем разным ферментам клеток Haemophilus aedyptius.
По особенностям субъединичной структуры и потребности в кофакторах ферменты системы рестрикции-модификации делят на 3 основных типа. При этом ферменты I и II типов узнают неметилированные последовательности в ДНК-субстрате.
Ферменты II типа включают 2 отдельных фермента: рестрикционную эндонуклеазу и модифицирующую метилазу. Нуклеазы II типа сыграли ключевую роль в разработке методов получения /7-ДНК, так как они в большинстве своем узнают последовательности, имеющие вращательную симметрию второго порядка и расщепляют ДНК по специфическим последовательностям полностью.
Различают 3 класса рестриктаз:
ферменты 1-го класса узнают на двуспиральной ДНК строго определенные нуклеотидные последовательности, осуществляя разрывы в произвольных точках; ферменты 2-го и 3-го классов узнают и расщепляют ДНК в строго определенных точках внутри сайтов узнавания или на фиксированном от них расстоянии. Ферменты 1-го и 3-го классов проявляют два типа активностей: метилирующей (модифицирующей) и АТФ-зависимой эндонуклеазой. Они имеют сложную субъединичную структуру. Ферменты 2-го класса состоят из двух отдельных белков: рест — рикцирующей эндонуклеазы и модифицирующей метил азы. Именно эти ферменты используют в генной инженерии. В соответствии с номенклатурой, применяемой для класса рестриктаз, первая буква рода и две первые буквы вида образуют сокращенное название источника выделения фермента, состоящее из трех букв, эндонуклеазы обозначают символом R, метилазы — М. Два (или более) фермента рестрикции, выделенные из одного типа клеток, нумеруют римскими цифрами. Например, рестриктазы Escherichia coli могут обозначаться как Eco RI или Eco RV и т. д. Большинство ферментов этого класса узнают последовательности, состоящие из 4—6 нуклеотидных пар, обладающих осью симметрии второго порядка.
Разрыв цепей ДНК может осуществляться либо по оси симметрии, в этом случае образуются фрагменты с «тупыми» концами, либо на некотором расстоянии от оси, тогда образуются фрагменты с выступающими «липкими» однонитевы — ми 5'- или З'-концами.
На рис. схематично показан процесс введения гена в плазмиду Escherichia coli и клонирование этого гена в клетках кишечной палочки. Плазмида Escherichia coli расщепляется рестрикционной эндонуклеазой на специфическом участке на обеих цепях ДНК, так что на концах расщепленной плазмиды располагаются короткие неспаренные последовательности дезоксирибонуклеотидов (ACTG или AGTG), т. е. по четыре нуклеотида, в которых основания представлены тимином и аденином соответственно.
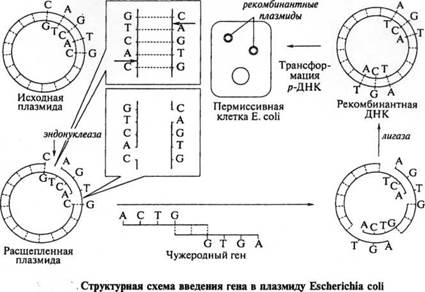
ген клетка молекула бактериофаг Ген, который нужно встроить в плазмиду, выщепляют с помощью этого же фермента рестрикции так, чтобы его концы были комплементарными нуклеотидными последовательностями на концах плазмиды (ААТТ и ТТАА). Обе ДНК (ген и плазмиды) сливаются с помощью лигазы. Затем рекомбинантную плазмиду вводят в клетку бактерии, которая, размножаясь, образует клон. При этом клетки содержат гибридную (рекомбинантную) плазмиду, следовательно, и чужеродный ген. Этот ген клонирован в клетках Escherichia coli, индуцируя в них синтез белка.
После расщепления плазмиды на ее концы с помощью фермента полинуклеотидтрансферазы можно нарастить последовательность из идентичных нуклеотидов: подобным образом на концах гена наращивается комплементарная последовательность такой же длины, т. е. если была достроена последовательность из четырех нуклеотидов, содержащих гуанин, то наращиваются четыре нуклеотида, содержащие цитозин.
Известно более 500 рестриктаз класса 2, но среди ферментов, выделенных из различных микроорганизмов, встречаются такие, которые узнают на ДНК одни и те же последовательности. Такие пары или группы называются изошизомерами. Если ферменты узнают одну и ту же последовательность нуклеотидов и разрывают ДНК в одних и тех же точках, то их относят к истинной изошизомерии; если узнают один и тот же сайт на ДНК, а разрывают ДНК в разных точках в пределах того же сайта, то их относят к ложной изошизомерии.
С целью получения неповрежденного гена расщепление проводят поочередно несколькими (узнающими шестерки, а не четверки нуклеотидов) рестриктазами либо применяют прием недорестрикции (расщепление лишь в одном сайте из нескольких возможных). Такой прием необходим, так как если сайт рестрикции окажется внутри гена (мишень для ферментов, указывающих последовательность из 4 нуклеотидов), то обработка ДНК рестриктазой приведет к его инактивации.
Существует несколько методов, посредством которых восстанавливается целостность молекулы ДНК:
- 1) отжиг участков, полученных после обработки ДНК, имеющих липкие комплементарные однонитевые концы, осуществляется лигазой. Она катализирует образование фосфороэфирной связи между соседними нуклеотидами, т. е. восстанавливает ковалентную непрерывность цепей ДНК. Необходимое условие в этом случае — значительное превышение концентрации фермента над концентрацией ДНК, которая также должна достигать высокой концентрации;
- 2) расщепление ДНК-вектора несколькими рестриктазами, что позволяет направить процесс в сторону получения рекомбинантных молекул вследствие уменьшения вероятности самосборки исходного вектора in vitro;
- 3) отщепление концевых фосфатных групп от линейной ДНК под действием щелочной фосфатазы. Этот метод успешно применяется как при воссоединении по тупым концам, так и при воссоединении фрагментов по липким концам;
- 4) присоединение к концам одного из соединяемых фрагментов ДНК однонитевого полинуклеотида, а к другому — комплементарного ему. Достроенные таким образом фрагменты смешивают и отжигают для образования кольцевых структур. Возможные бреши обрабатывают эндонуклеазой типа III, ДНК-полимеразой и лигазой, в результате чего образуются ковалентно замкнутые кольцевые молекулы.
Гены, выделяют из генома определенного организма, вводят в клетки другого организма посредством специальных ДНК-век торов. Вектором называется та часть рекомбинантной ДНК, которая обеспечивает ее проникновение и рекомбинацию в «клеткехозяине». Другими словами, векторами называют молекулы ДНК способные переносить и стабильно поддерживать в рецитентны> клетках чужеродную генетическую информацию. Векторные молекулы являются основным инструментом генной инженерии. И> назначение — хранить, переносить исследуемые гены и умножать их число.
ДНК-вектор должен отвечать определенным требованиям. Векторы получают от естественных репликонов (репликоном называется автономно реплицирующаяся молекула ДНК, содержащая репликатор): плазмид, бактериофагов, вирусов. Вектор должен содержать сайты рестрикции, при этом места разрезания и введения другой ДНК не должны влиять на репликацию вектора. При помощи такого вектора можно умножать (амплифицировать) гены. Чтобы ген экспрессировался, вектор должен содержать специфические для данной клетки промоторы и терминаторы («стоп"-кодоны) транскрипции. В то же время РНК-транскрипт будет транслироваться, если РНК содержат сигналы связывания с рибосомами, кодоны инициации и терминации трансляции. Векторные молекулы делят на векторы прокариот и векторы эукариот. Векторы прокариот получают от плазмид, фагов и их комбинаций. В 1978 г. Дж. Коллинз и В. Хон описали новый тип векторных молекул — космиды. Это плазмиды, несущие cos-участок (липкие концы) ДНК фага, А и репликатора, гены устойчивости к антибиотикам и уникальные сайты рестрикции от плазмид. Наличие cos-учаетка позволяет производить упаковку ДНК в головку фага in vitro. Имея наибольшую емкость, cos-учаетки специально предназначены для клонирования больших фрагментов эукариотической ДНК и создания клонотек геномов.
Известны также другие векторы — фазмиды. Это гибриды между фагами и плазмидами, способные развиваться и как фаг, и как плазмида. Общим для векторов является понятие о клонирующей емкости. Под емкостью вектора понимают размер фрагментов ДНК, которые можно встроить в вектор и стабильно поддерживать в его составе in vivo. Причем, если для векторов, созданных на основе ДНК-фагов, это понятие касается точного размера клонируемого фрагмента, определяемого объемом головки фага и размером вектора, то для плазмидных векторов оно ассоциируется со стабильностью в клетке /ьДНК, включившей слишком большой или слишком маленький фрагмент, т. е. емкость в таких случаях не имеет четких границ. По клонирующей емкости фазмиды уступают космидам и сравнимы лишь с векторами на основе фага А.
Однако относительная простота комплементарного анализа дает им главное преимущество. Векторы эукариот — это челночные векторы для трансформации дрожжевых клеток. С помощью этого материала можно трансформировать дрожжевые клетки и получать экспрессию гена. Сконструированы минихромосомы, способные функционировать в клетках дрожжей. Созданы векторы для трансформирования грибов, высших растений и животных. Из генно-инженерных систем для клонирования фрагментов чужеродной ДНК наиболее разработанной является система грамотрицательной бактерии Esherichia coli, в которой традиционно используют несколько типов векторов: производные плазмид, производные ДНК бактериофагов Esherichia coli, гибриды между плазмидными и фаговыми ДНК — космиды и фазмиды.
Хотя эти векторы различаются по емкости и структуре, все они должны отвечать общим требованиям, предъявляемым к векторам. В большинстве случаев эксперимент по молекулярному клонированию проводят, используя сложную смесь фрагментов ДНК. Чтобы отобрать клоны, содержащие рекомбинированные молекулы, существуют специальные методы, позволяющие провести идентификацию по изменению фенотипа клетки под влиянием вновь синтезированного белка либо по свойствам самого белка с привлечением методов прямой радиоиммунологической детекции колоний и гибридизационной селекции.