Оперативная хирургия.
Основные методы исследования животных

Берут длинную мягкую и прочную веревку и натирают ее мылом или тальком для лучшего скольжения и меньшего травмирования кожи. Веревку закрепляют на рогах, затем ею охватывают туловище животного дважды, делая петли в области груди и на уровне голодной ямки. В зависимости от стороны, на которую валят животное, веревку скрещивают на туловище слева или справа. При этом вымя или половой член не должны… Читать ещё >
Оперативная хирургия. Основные методы исследования животных (реферат, курсовая, диплом, контрольная)
1. Подготовка рук хирурга. Поскольку руки ветеринарного врача постоянно соприкасаются с объектами, загрязненными микроорганизмами, то подготовка рук перед операцией имеет важное значение.
Обработка рук хирурга состоит из трех этапов: 1) механическая очистка; 2) обработка антисептическими и 3) дубление кожи.
Руки готовят по одному из перечисленных способов:
ь способ Оливкова. Руки сначала моют в течение 5 мин горячей водой (40—50°С) щеткой с мылом. После этого вытирают насухо грубым полотенцем и обрабатывают в течение 3 мин тампонами, смоченными спиртовым раствором йода 1:3000. Дополнительно подногтевые пространства и ногтевые ложа обрабатывают 5%-ным спиртовым раствором йода.
При гнойных операциях повторную обработку следует проводить йодированным спиртом в разведении 1:1000;
Таким способом обрабатывала руки перед кастрацией хряка (26.07.2006г) ь способ Спасокукоцкого—Кочергина. Руки моют в двух тазиках с 0,5%-ным раствором аммиака в течение 5 мин. Затем вытирают полотенцем и обрабатывают 70°-ным спиртом 5 мин. Подногтевые пространства обрабатывают 5% -ным раствором йода;
Этот способ применяла перед кастрацией хрячков (27.07.06г) ь способ Кияшова основан на использовании 0,5% -ного раствора аммиака, в котором руки моют щетками 5 мин и вытирают полотенцем. Завершают подготовку рук обработкой 3% -ным раствором сульфата цинка в течение 3 мин, а подногтевые пространства и ногтевые ложа — дополнительно 5%-ным раствором йода.
2. Стерилизация инструментов, белья и шовного материала.
Стерилизация шовного материала.
Стерилизация шелка. Нити предварительно мыла и тщательно споласкивала, затем рыхло наматывала на предметные стекла и обрабатывала по способу Садовского. Мотки шелка помещают на 15 мин в 0,5%-ный раствор нашатырного спирта, а затем на 15 мин в 2%-ный раствор формалина, приготовленного на 70% -ном спирту.
Стерилизацию кетгута проводится по способу Губарева. Кетгут помещала на 72 ч в 4% -ный водный раствор формалина.
Стерилизация хлопчатобумажных и льняных нитей.
Эти нити обладают меньшей прочностью, чем шелковые. Обычно пользуются нитями № 10—20, которыми зашивают дефекты кожи, при шве на внутренних органах применяют более тонкие номера. Стерилизовала хлопчатобумажные и льняные нити путем погружения на 24 ч в 4%-ный раствор формалина.
Стерилизация перевязочного материала, хирургического белья и посуды осуществляются автоклавированием. Продолжительность стерилизации зависит от показаний манометра: при 1 атм./126,8° - 30 мин, при 2атм./132,9° - 20 мин.
Стерилизацию текучим паром осуществляют либо в специальном текучепаровом стерилизаторе Коха, либо используют кастрюлю или ведро с крышкой (поскольку аппарата Коха в наличии не было использовала эмалированную кастрюлю с крышкой). Продолжительность стерилизации не менее 30 мин.
Стерилизация утюжением белья и перевязочного материала допускается только в тех случаях, если нельзя применить другие способы. Температура утюга 150градусов; сначала раскладывала простыню и тщательно ее проглаживала, затем обрызгивала водой необходимый материал и проглаживала его с обеих сторон (марлю с одной стороны), на этой, предварительно проглаженной простыне, при этом утюг продвигала медленно по 2−3 раза на одном месте. Утюженное белье стерильным тампоном складывала в бикс или в пакет.
Бикс.
Стерилизация хирургических инструментов. Существуют холодные и горячие способы стерилизации инструментов. К горячим относят стерилизацию кипячением в воде, фламбирование и др.; к холодным — стерилизацию в тройном растворе Каретникова, другие прописи, диацид, пливасепт и пр.
При прохождении практики использовала следующие методы стерилизации инструментов:
Стерилизация кипячением в воде. Проводят ее в стерилизаторах (или эмалированной посуде). Вымытые инструменты, шприцы, иглы и др. кипятят 30 мин в дистиллированной или кипяченой воде.
Для повышения эффекта стерилизации инструменты кипятят в 3%-ном растворе двууглекислой соды или в 0,25%-ном растворе едкого натрия 10—15 мин.
Холодный способ стерилизации в тройном растворе Каретникова. Раствор состоит из 20 г формалина, 3 г фенола и 1 л дистиллированной воды. Экспозиция —30 мин.
Предварительная (заблаговременная) стерилизация инструментов. Для экстренных операций необходимо заранее простерилизовать инструменты. Предварительную стерилизацию осуществляла по способу Андреева. Инструменты складывают в двухслойный полотняный мешочек, который туго завязывают и опускают в кипящий 20%-ный раствор углекислой соды на 15 мин (считая с момента второго закипания раствора). После этого мешочек извлекала, подвешивала для стекания раствора и высушивания.
Кипячение инструментов в 20%-ном растворе углекислой соды без последующего их протирания не вызывает коррозии. Инструменты сохраняют стерильность несколько месяцев.
3. Анестезия.
При прохождении практики при кастрации хряка использовала местную анестезию, с предварительным применением нейролептика — стреснила (азаперон).
Стреснил — эффективное седативное средство для свиней, применяемое внутримышечно в 4% - ном растворе. У свиней местом внутримышечной инъекции чаще всего являются — мышцы шеи у основания уха, внутренная поверхность бедра, ягодичные мышцы, трехглавая мышца плеча. В данном случае местом инъекции явилась ягодичная мышца. Вводила из расчета 2мг/кг. После этой предварительной подготовки животному в толщу каждого семенника инъецировала по 10 мл 3%-ного раствора новокаина. Дополнительно раствор вводила подкожно по линии разреза мошонки.
4. Фиксация животных при операциях.
Для животных каждого вида применяют методы фиксации, разнообразие которых зависит от состояния больного и характера оперативного вмешательства. Обычно животное фиксируют в стоячем или лежачем положении.
При фиксации крупного рогатого скота в целях проведения оперативного вмешательства в стоячем положении необходимо укрепить голову. Для этого носовую перегородку сдавливают пальцами или носовыми щипцами и захватывают один рог. У быков пожизненно вставляют носовые кольца, за которые фиксируют рукой или специальными водилами.
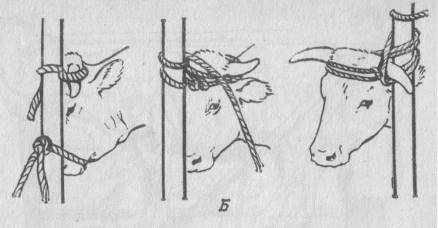
Грудную или тазовую конечности приподниманием или применяют закрутки на предплечье или голень веревочной петлей, или деревянным бруском; иногда конечность сгибают в запястье и связывают ее веревкой в области пясти.
Наилучшая фиксация достигается в станках, При некоторых операциях относительно спокойных животных можно укреплять возле стены или забора оградив шестом тазовые конечности.

При проведении руменоцентеза во время летней практики использовали фиксацию животного в стоячем положении, зафиксировав голову животному.
Если необходим повал крупного рогатого скота, то наиболее приемлемым является способ Гесса.
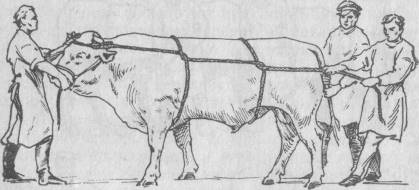
Берут длинную мягкую и прочную веревку и натирают ее мылом или тальком для лучшего скольжения и меньшего травмирования кожи. Веревку закрепляют на рогах, затем ею охватывают туловище животного дважды, делая петли в области груди и на уровне голодной ямки. В зависимости от стороны, на которую валят животное, веревку скрещивают на туловище слева или справа. При этом вымя или половой член не должны быть ущемлены. Два помощника натягивают веревку и хвост в ту сторону, куда хотят повалить животное, а стоящий у головы помощник запрокидывает последнюю, помогая придать животному желаемое положение. Веревку ослабляют только после того, как конечности б прочно укреплены. При боковом положении их связывают вместе и растягивают. Для свободного доступа к области мошонки ответствующую тазовую конечность подтягивают к груди веревкой, пропущенной под шеей и завязанной на путе. Прочность этого крепления должна быть безупречной, так к случае разрыва веревки или ее ослабления животное может нанести ногой смертельный удар. Для укрепления в спинном положении натянутые вверх конечности попарно привязывают к прочному и длинному шесту, который удерживают либо помощники, либо его крепят к потолку помещения.
При оперативном вмешательстве свиней фиксируют также либо в стоячем положении либо с помощью повала.
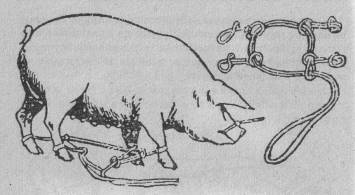
На область пястей и плюсн накладывают веревочные петли с кольцами; сквозь них пропускают вдвое сложенную длинную веревку, проходящую через свою собственную петлю. Свинью сваливают, сближая ноги и сгибая голову второй веревкой, петля которой затянута на верхней челюсти.
Такой метод использовали во время летней практики при кастрации молодых хрячков.
В стоячем положении свинью можно укрепить подтягиванием ее головы к полу. Для этого сделанную на конце длинной веревки подвижную петлю затягивают на верхней челюсти позади клыков. Свободный конец веревки привязывают у основания вкопанного в землю столба или к вделанному в пол кольцу. При такой фиксации свинья не может лечь. При непродолжительных манипуляциях помощники удерживают животное за хвост и веревку, укрепленную на верхней челюсти. Хорошая фиксация свиней достигается захватыванием верхней челюсти специальными щипцами.
В стоячем положении фиксировала взрослого хряка при проведении кастрации открытом способом.

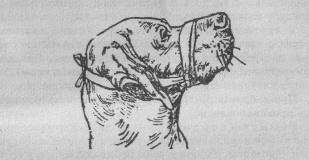
Укрепление собак и кошек требует исключительной осторожности в целях самозащиты от укусов, царапин и связанной с ним угрозой возможного заражения бешенством. У собак смыкают челюсти наложением на них петли из тесьмы: сначала делают один узел под челюстями, а конец тесьмы завязывают на затылке распускающимся узлом.
Кошку берут рукой за кожные складки шеи и поясницы и помещают в специальный кожаный мешок или заворачивают в плотную ткань. При длительных и болезненных манипуляциях этим животным вводят общеуспокаивающие и наркотические средства.
Фиксация птиц Птиц фиксируют, удерживая их в естественном положении за конечности и крылья. Но при фиксации птиц следует помнить о том, что нельзя сдавливать грудную клетку, т.к. это может привести к удушению.
5. Инъекции.
Инъекция (лат. injectio — вбрасывание, син. впрыскивание) — введение жидких форм лекарственных веществ или биологических препаратов толщу тканей, полости организма, сосудистое русло.
Введение
больших количеств жидкости (различных растворов, крови, кровезаменителей и др.) преимущественно самотеком называют вливанием (лат. infusio).
Инъекции и вливания осуществляют в тех случаях, если введение лекарства внутрь невозможно, нецелесообразно или если нужно получить быстрый лечебный эффект.
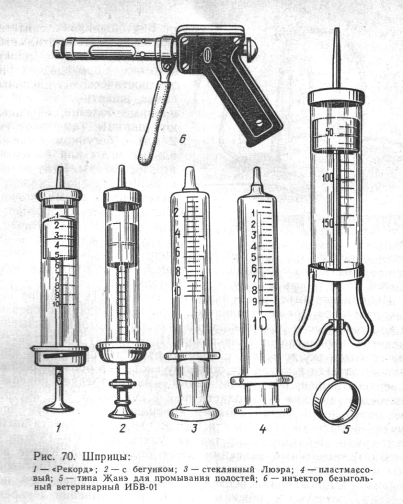
Делают их с помощью шприца (через иглу) безыгольного инъектора или специальных систем Шприцы выпускают вместимостью 1, 2, 5, 10, 20 мл. Шприцы типа Люэра (на 2″ 5, 10, 20, 50, 100 мл) состоят целиком из стекла. Для них требуются иглы с большим диаметром внутреннего конуса канюли. При необходимости использования игл к шприцам типа «Рекорд» в сочетании с шприцами типа Люэра или наоборот применяют переходные канюли. Выпускают также одноразовые стерильные пластмассовые шприцы. Для вливаний, переливания крови и промывания полостей организма используют шприцы типа Жанэ, аппарат Боброва, стеклянные воронки и др. (рис. 71).
Иглы инъекционные различной длины и диаметра к шприцам типа «Рекорд» и Люэра выпускают под номерами: первые две цифры обозначают диаметр трубки в десятых долях миллиметра, я последующие — длину трубки в миллиметрах. Для прочистки канала иглы снабжены тонкой проволочкой — мандреном.
Инъекции и вливания должны проводить при строгом соблюдении всех правил профилактики хирургической инфекции — стерилизации инструментов, вводимых жидкостей, подготовки рук и операционного поля. Инъекции бывают диагностическими, лечебными и профилактическими. В зависимости от путей введения жидкости различают внутрикожные, подкожные, внутримышечные, внутривенные, внутриартериальные, внутрибрюшинные, внутрисиновиальные, внутрисердечные и другие инъекции.
Внутрикожные инъекции выполняют преимущественно для введения аллергических препаратов при диагностическом исследовании животных на инфекционные болезни. Применяют шприцы (вместимость 2 мл) с бегунком и специальные иглы или безыгольные инъекторы. Иглу вводят в толщу кожной складки, захваченной двумя пальцами, параллельно поверхности кожи. Место инъекции: у крупных животных — боковая поверхность средней трети шеи; у мелкого рогатого скота — подхвостовая складка; у свиней — наружная или внутренняя поверхность уха; у кур — бородка.
Подкожные инъекции — наиболее частый путь введения водных растворов (реже масляных). Противопоказаны суспензии, гипертонические и раздражающие растворы, которые вызывают развитие инфильтратов и некрозов. Иглу вводят под оттянутую кожную складку в местах с хорошо развитой подкожной клетчаткой: лошади и крупному рогатому скоту — в области боковой поверхности шеи, подгрудка; овцам — на внутренней поверхности бедра; свиньям — в области шеи у основания уха, внутренней поверхности бедра; собакам и кошкам — в области шеи. груди, внутренней поверхности бедра; птице — в области затылка и груди. Действие лекарства наступает через 10—15 мин.
Внутримышечные инъекции менее болезненные. Кроме водных можно вводить масляные растворы и суспензии. Противопоказаны раздражающие вещества. Мышцы обильнее, чем подкожная клетчатка, снабжены кровью и всасывание лекарства идет быстрее. У крупных животных местом инъекции является заднебедренная группа мышц, мышцы шеи, подгрудка, трехглавая мышца плеча; у свиней — мышцы шеи у основания уха, внутренная поверхность бедра, ягодичные мышцы, трехглавая мышца плеча (рис. 72); у собак и кошек — заднебедренная группа мышц, внутренняя поверхность бедра, трехглавая мышца плеча; у птиц — область грудной кости и бедра.