Бор.
Общая химия

Кристаллы бора получаются из газообразной смеси бромида бор и водорода осаждением на раскаленной танталовой проволоке. Кристаллическая структура бора не имеет аналогов. Он образует двадцатигранники — икосаэдры с 12 вершинами, по которым располагаются атомы бора. Рас личная упаковка икосаэдров в кристаллах обусловливает возникновение ряда разновидностей простого вещества. Борную кислоту применяют… Читать ещё >
Бор. Общая химия (реферат, курсовая, диплом, контрольная)
Бор — единственный неметалл, на внешнем р-подуровне которого имеется всего один электрон. В кристаллическом состоянии бор является полупроводником. Это свойство, а также сходство свойств водородных соединений и галогенидов сближает бор с находящимся в группе 1УЛ кремнием. Как бор, так и кремний характеризуются электроотрицательностью X = 1,8, меньшей, чем у водорода. В таблице Менделеева бор и кремний расположены по диагонали, вследствие чего явление сходства между ними и некоторыми другими элементами, расположенными в таблице подобным образом, получило название диагонального сходства.
В природе бор встречается в виде минерала буры, или тетрабората натрия N32607- ЮН20, в некоторых соляных озерах и горячих источниках. В вулканических районах находят также борную кислоту Н3В03. Ежегодно добывается более 1 млн т соединений бора. Бор входит в состав сплавов железа и цветных металлов. Кислородные соединения бора добавляются в некоторые виды стекла, эмали и глазури. Бура применяется при пайке металлов. Нуклид имеет большое значение в ядерной технике, так как поглощает нейтроны, возникающие в реакторах. При реакции с нейтроном ядро бора превращается в ядра лития и гелия. Нуклид ВВ, в противоположность первому, совершенно не реагирует с нейтронами и тоже применяется в ядерной технике.
Бор получается в виде серого порошка, называемого аморфным бором, при восстановлении оксида бора магнием:
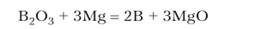
Кристаллы бора получаются из газообразной смеси бромида бор и водорода осаждением на раскаленной танталовой проволоке. Кристаллическая структура бора не имеет аналогов. Он образует двадцатигранники — икосаэдры с 12 вершинами, по которым располагаются атомы бора. Рас личная упаковка икосаэдров в кристаллах обусловливает возникновение ряда разновидностей простого вещества.
Кристаллы бора по твердости приближаются к алмазу. Температура плавления высокая — 2075 °C. При обычной температуре бор химически очень устойчив. Горячие концентрированные азотная и серная кислоты медленно окисляют бор:
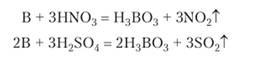
Подобно кремнию, бор растворяется в концентрированной щелочи:
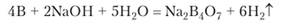
При сильном нагревании (~700°С) бор реагирует с галогенами, кислородом, серой, например:

Оксид бора — белое кристаллическое вещество, плавящееся при 450 °C и переходящее при охлаждении в стеклообразную массу. С водой образует борную кислоту, а со щелочами — ее соли.
При реакции бора с хлором образуется газообразный (?К|Ш = 12,6°С) при обычной температуре хлорид бора:

Это вещество состоит из плоских молекул с делокализованной тт-связыо, образующейся при участии электронных пар хлора и вакантной р-орбитали бора (рис. 24.1).
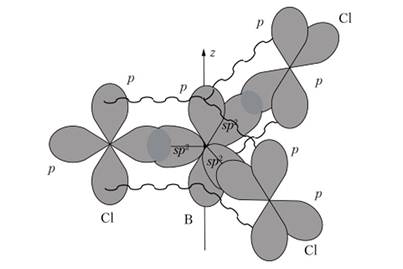
Рис. 24.1. Модель перекрывания орбиталей в хлориде бора:
волнистыми линиями показано перекрывание негибридных р-орбиталей Хлорид бора применяется для получения бора особой чистоты и для разделения изотопов бора. Хлорид бора полностью гидролизуется с образованием борной кислоты и хлороводорода:
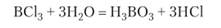
Фторид бора, подобно другим фторидам неметаллов, гидролизуется в незначительной степени. При растворении в плавиковой кислоте он образует комплексную кислоту Н[ВР4]. Это сильная кислота, образующая много солей. Соль натрия Ыа[ВР4] хорошо растворима в воде, а соль калия К[ВР4] малорастворима.
При нагревании до 1200 °C бор реагирует с азотом, образуя нитрид бора:
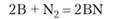
Два атома, бор и азот, имеют в сумме восемь валентных электронов, так же как два атома углерода. В результате простые вещества углерода и нитрид бора изоэлектронны, т. е. имеют одинаковый набор валентных электронов.
Это оказывается причиной образования нитридом бора кристаллических структур типа графита и алмаза. а-Нитрид бора имеет графитоподобную слоистую структуру, но это вещество белого цвета. В отдельном слое чередуются атомы бора и азота (рис. 24.2, а). Вследствие обобществления валентных электронов на атомах азота появляется формальный заряд +1, а на атомах бора -1. При высоком давлении а-ВК превращается в р-ВЫ (боразон), вещество черного цвета с алмазоподобной структурой (рис. 24.2, б), отличающейся тем, что половина атомов углерода заменена на атомы бора, а другая половина — па атомы азота. Кристаллы р-ВК имеют твердость алмаза, но более термостойки и менее хрупки, чем алмаз. Вещество применяется в технике.

Рис. 24.2. Структуры ?-BN (а) и p-BN (б)
Комбинация бора и азота даст и другие вещества, изоэлектронные соединениям углерода. Ярким представителем таких веществ является боразол В3Ы3Н6, «неорганический бензол», как бы повторяющий структуру бензола:
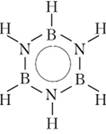
Боразол — жидкость, кипящая при 55 °C. Атомы водорода, связанные с бором, могут замещаться на органические радикалы и атомы галогенов.
С металлами бор образует бинарные соединения бориды, известные в виде индивидуальных соединений и присутствующие в сплавах. Формулы боридов часто не соответствуют обычным валентностям атомов. Это очевидно из следующих примеров боридов, являющихся практически важными материалами: М^В2, 'ПВ2, СгВ2, ЬаВ(•, СаВ6.
Необычным классом соединений являются бороводороды, или бораны. Простейший бороводород диборан В2Нб по составу аналогичен этану, но в нем нет непосредственной химической связи между атомами бора, так как в молекуле, по сравнению с этаном, недостает двух электронов. Поэтому между водородом и бором возникают две трехцентровые связи ВИВ (см. рис. 6.25). Диборан с примесью других бороводородов образуется при реакции борида магния с раствором кислоты:
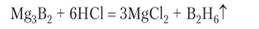
Выходя на поверхность раствора, пузырьки диборана самовоспламеняются. В этом проявляется сходство бороводородов с кремневодородами:

Одновременно с дибораном образуется тетраборан (боробутан) В^Ню. Известны и другие бороводороды: В5Н9, В-Ни, В6Н10, В10Н14. В сложных бороводородах имеются как трехцентровые связи, так и связи между атомами бора. Приведем структурную формулу теграборана, в которой выделены атомы водорода, образующие трехцентровые связи:

Как и кремневодороды, бороводороды гидролизуются с выделением водорода:
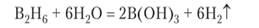
При реакции с гидридом щелочного металла диборан образует комплексное соединение с гидрид-ионами в качестве лигандов:
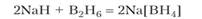
Борогидрид натрия растворим в воде, но в растворе постепенно разлагается с выделением водорода. Борогидриды применяются в органической химии в качестве восстановителей.
Наиболее давно известными соединениями бора являются борная кислота и ее соли — бораты.
Борная кислота — белое кристаллическое вещество, малорастворимое в холодной воде и проявляющее очень слабые кислотные свойства. Ионы водорода в растворе этой кислоты образуются не в результате обычной реакции ионизации, а путем связывания гидроксид-иона из молекулы воды:
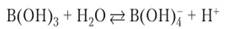
Присоединение иона ОН происходит за счет электронной пары кислорода и свободной 2р-орбитали бора. Бор проявляет себя как кислота Льюиса. При нейтрализации борной кислоты двухи трехзамещенные соли не образуются. Образующиеся первоначально ионы В (ОН)4 подвергаются в растворе превращениям, связанным с конденсацией нескольких ионов в одну частицу. К числу таких ионов относятся тетраборат-ион В4О7- и пентаборат-ион В506(0Н)4. В присутствии ионов металлов и при достаточной концентрации раствора в первую очередь кристаллизуется наименее растворимая соль. В случае натрия это тетраборат Ка2В407• ЮН20. В случае калия — пентаборат КВ-06(0Н)4 -2Н20. Литий образует простой борат 1лВ (ОН)4-6Н20. Реакция нейтрализации борной кислоты гидроксидом натрия записывается так:
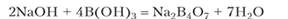
При сплавлении оксида бора со щелочами образуются метабораты:
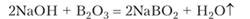
Метабораты термически устойчивы. Например, метаборат натрия плавится при 966 °C и кипит при 1434 °C без разложения. В водной среде метабораты в процессе растворения превращаются в гидратированные ионы разного состава, и при достаточной концентрации выделяется кристаллогидрат, характерный для данного катиона.
Борная кислота при кипячении со спиртами в присутствии серной кислоты образует летучие эфиры:
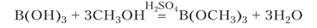
При поджигании паров спирта над раствором возникает зеленое пламя, указывающее на присутствие летучего соединения бора. Реакция используется для обнаружения примеси бора в различных образцах смесей.
Борную кислоту применяют как противомикробное средство при некоторых заболеваниях кожи и слизистых оболочек. Бораты применяются как компоненты стекол, глазурей, флюсов (при рафинировании металлов). При пайке и сварке металлов расплавленный борат растекается по поверхности металла, растворяя оксиды и предотвращая контакт с воздухом.