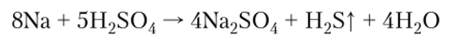Простые вещества.
Общая и неорганическая химия для фармацевтов

Для получения остальных металлов этот метод непригоден из-за высокой химической активности при повышенных температурах. Расплавленные щелочные металлы заметно испаряются в вакууме. Летучесть щелочных металлов позволяет восстанавливать их из оксидов и солей менее активными металлами (и менее летучими), коксом и кремнием. Взаимодействие металлов с водой приводит к образованию щелочей, причем… Читать ещё >
Простые вещества. Общая и неорганическая химия для фармацевтов (реферат, курсовая, диплом, контрольная)
Получение. Получение щелочных металлов требует высоких энергетических затрат. В промышленности литий и натрий получают электролизом расплава хлоридов в электролизере с диафрагмой, разделяющей катодное и анодное пространства:
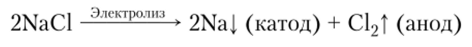
Для получения остальных металлов этот метод непригоден из-за высокой химической активности при повышенных температурах. Расплавленные щелочные металлы заметно испаряются в вакууме. Летучесть щелочных металлов позволяет восстанавливать их из оксидов и солей менее активными металлами (и менее летучими), коксом и кремнием.
Калий получают действием паров натрия на расплав хлорида или гидроксида калия. Образующийся при этом сплав металлов разделяют перегонкой.
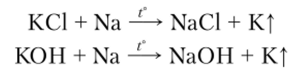
Рубидий и цезий получают восстановлением хлоридов кальцием:
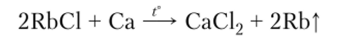
В лаборатории часто используют цирконий, дающий прочный оксид: 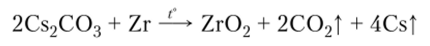
Восстановительные методы известны и для легких металлов:
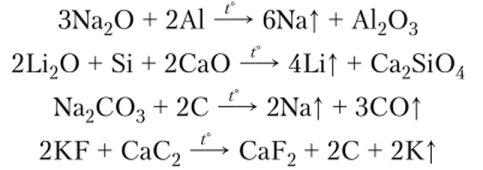
Химические свойства. Щелочные металлы в химических реакциях проявляют только восстановительные свойства. В качестве окислителей могут выступать простые вещества — неметаллы, оксиды, кислоты, соли, некоторые органические соединения.
В химических реакциях атомы щелочного металла отдают свой единственный валентный электрон, превращаясь в катион:
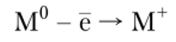
Несмотря па общность свойств, натрий, и в особенности, литий отличаются от других металлов. Малый размер атома лития, высокая плотность заряда и низкое координационное число делают химические свойства лития ближе к свойствам магния (диагональное сходство в Периодической системе). Рубидий и цезий по свойствам близки калию. При изложении химических свойств мы будем отмечать особенности того или иного металла.
1. Щелочные металлы реагируют при нагревании с водородом с образованием гидридов солеобразной структуры:
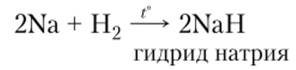
При действии воды или кислот гидриды выделяют водород:
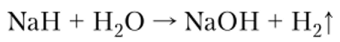
2. С азотом с образованием нитрида легко реагирует только литий. Реакция возможна и при комнатной температуре, но проводят ее при 350 °C. Остальные металлы образуют малоустойчивые нитриды при 100—500°С.
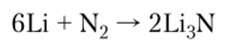
При действии воды нитрид выделяет аммиак:
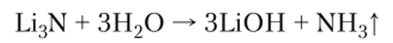
3. С углеродом или ацетиленом непосредственно взаимодействуют только литий и натрий, образуя карбиды М2С2 (ацетилениды), при гидролизе которых выделяется ацетилен:
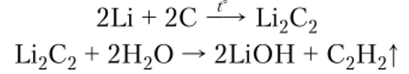
Калий, рубидий и цезий карбидов не образуют, но при взаимодействии с графитом способны внедряться между его слоями, образуя соединения включения переменного состава.
4. Все щелочные металлы реагируют с галогенами и серой с образованием галогенидов и сульфидов соответственно:
2Na + Cl2 —? 2NaCl (горит в атмосфере хлора при обычной температуре); 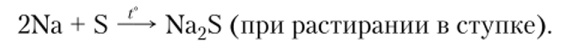
В реакции с серой возможно образование иолисульфидов Na2S" (п =.
- -2−5).
- 5. Взаимодействие металлов с водой приводит к образованию щелочей, причем энергичность, с которой протекает реакция, повышается при переходе от лития к цезию — натрий часто воспламеняется, а остальные щелочные металлы реагируют со взрывом:
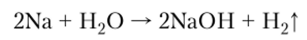
Относительно низкая активность лития в реакции с водой объясняется его твердостью и большей температурой плавления по сравнению с другими металлами, поэтому он медленнее дробится на капли и спокойнее реагирует.
6. Реакция с кислотами происходит еще более бурно, чем с водой, и не имеет практического применения, поскольку соответствующие соли проще получать реакцией нейтрализации:
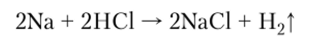
С умеренно разбавленной и концентрированной серной кислотой щелочные металлы реагируют с выделением сероводорода: