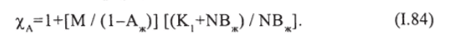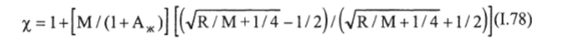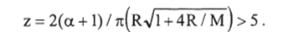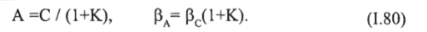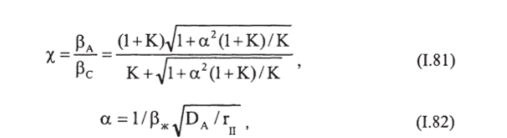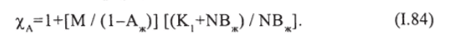В этом случае коэффициент ускорения равен:
при условии.
При допущении, что вблизи границы раздела фаз концентрация активной части поглотителя В постоянна, концентрация компонента, А изменяется линейно при удалении от границы раздела фаз, а Аж пренебрежимо мало по сравнению с Ар, получено уравнение:
где, а = М-(х-1)/М; R = l/p,^DAr В.; М = (В"/ nAp) (DB / DA); tha = [ехра-ехр (-а)] / [expa+exp (-a)J — гиперболический тангенс; гп — константа скорости реакции второго порядка, м3/(кмоль.с).
Для вычисления х построен график (рис. 1−22,6), на котором показана зависимость х от R и М. Из рисунка следует: при R<0,5% =1; при R >5М х = М+1; при М >5R и R >2 х к R, или рж = ^DArnB, .
Обратимая реакция первого порядка.
Константа равновесия реакции В- *А равна К = гп/ го=В / А.
Если, А — концентрация свободного компонента в жидкости, а С=А+В — общая концентрация компонента, то эти концентрации и коэффициенты массоотдачи будут связаны между собой следующими соотношениями: 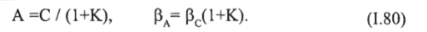
Тогда коэффициент ускорения будет равен:
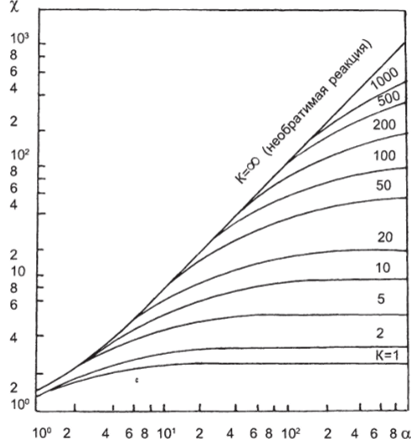
Рис. 1.22, а. Зависимость х от, а при различных К для реакций первого порядка где, rM, ro — константы скорости прямой и обратной реакции, 1/с; РА и Рс — коэффициенты массоотдачи, определяемые соответственно при движущей силе, равной (Ар — Аж) и (ср — сж).
Для вычисления хА можно использовать рис. 1−22, а. При К=0 Х=1, что соответствует физической абсорбции; при К = оо — соответствует необратимой реакции.
При использовании в расчетах рс коэффициент ускорения равен:
Хс = Рс /Р* = Ха /0 + К) = т/1 + «2(1 + К)/К/[к + Vl + a2(l + К)/к]. fl.83).
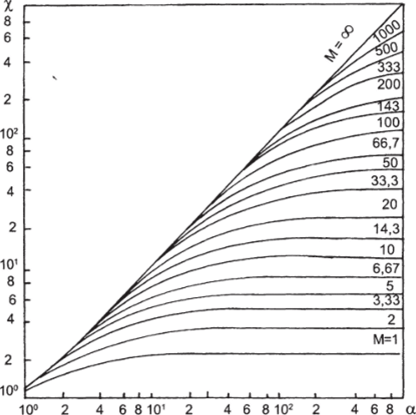
Рис. 1−22, б. Зависимость х от R при различных М для реакций второго порядка В этом случае ус<1, т. е. коэффициент р-с ниже, чем коэффициент массоотдачи при физической абсорбции — Рж
Для абсорбции, сопровождаемой медленной обратимой реакцией, например, поглощения S02 или С12 водой, коэффициент ускорения может быть рассчитан по формуле: