Протолитическая теория Брёнстеда — Лоури

Данная система представлений характеризует кислоты как вещества, отдающие протоны (доноры протонов), а основания — как вещества, способные соединяться с протонами (акцепторы протонов). Из этого следует, что реакция нейтрализации сводится к переносу протонов от кислоты к основанию. Теряя протон, кислота превращается в основание, поскольку в результате обратной реакции образовавшееся вещество может… Читать ещё >
Протолитическая теория Брёнстеда — Лоури (реферат, курсовая, диплом, контрольная)
Данная система представлений характеризует кислоты как вещества, отдающие протоны (доноры протонов), а основания — как вещества, способные соединяться с протонами (акцепторы протонов). Из этого следует, что реакция нейтрализации сводится к переносу протонов от кислоты к основанию. Теряя протон, кислота превращается в основание, поскольку в результате обратной реакции образовавшееся вещество может присоединить протон. Аналогично основание, присоединив протон, становится кислотой. Такая взаимосвязь между кислотами и основаниями может быть выражена уравнениями, сумма которых представляет собой реакцию нейтрализации:

Таким образом, реакция нейтрализации может рассматриваться как процесс, в котором имеет место конкуренция за обладание протоном.
Вещества Aj и В, называют сопряженной системой или парой, поскольку кислота Ар теряя протон, образует сопряженное ей основание В, а основание В2 образует сопряженную ему кислоту А.; за счет присоединения протона. Кислотами и основаниями могут быть нейтральные молекулы, положительные или отрицательные ионы, например:
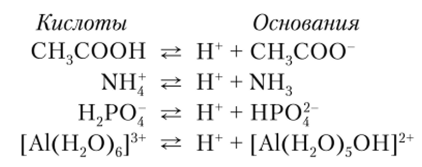
Из представлений Брёнстеда — Лоури следует, что вода, как и многие другие вещества, способные не только отдавать, но и присоединять к себе протоны, обладает амфотерными свойствами. В присутствии более сильных оснований вода ведет себя как кислота, а в присутствии более сильных кислот — как основание:
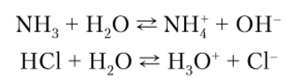
Положения равновесия зависят от относительной протонодонорной способности участвующих в реакции веществ. Так, для НС1 равновесие сильно смещено вправо, поскольку НС1 — лучший донор протонов, чем образующийся Н30+; хлорид-ион — худший акцептор протонов, чем вода. С1 представляет собой слабое основание, сопряженное сильной кислоте НС1, поскольку последняя является слабым акцептором протонов. При наличии же NH3 слабой кислоте Н20 отвечает сильное сопряженное основание ОН .
Согласно представлениям Брёнстеда — Лоури сила кислоты определяется константой кислотности Ка, илиКк, а сила основания — константой основности Kh, или Коси. Исходя из равновесия.
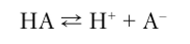
имеем.

Для осуществления этого равновесия в растворе необходимо присутствие акцептора протона, благодаря которому осуществляется переход протона от кислоты к основанию:
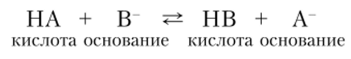
Реакции данного типа называются протолитическими, количественная сторона которых характеризуется константой равновесия (константой протолиза):

Значения Ка для НА и НВ можно определить следующим путем: 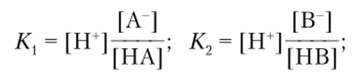 тогда.
тогда.
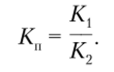
Так, для реакции 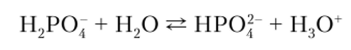 получаем
получаем 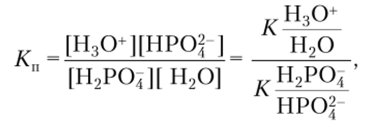
т.е. константа выражается через отношение констант кислотности соответствующих брёнстедовских кислот. Сила основания определяется константой основности Kh, которая соответствует равновесию.
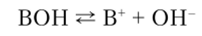
и равна.

Определение для системы растворителей. Этим определением пользуются в тех случаях, когда для растворителя наблюдаются в заметной степени процессы аутоионизации независимо от того, участвуют в этом процессе протоны или пет. Согласно этому определению под кислотой понимают вещество, способное к образованию катиона, характерного для данного растворителя, а под основанием — вещество, способное к образованию аниона, характерного для данного растворителя. Например:
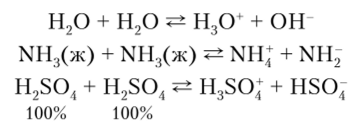
Вещества, которые при растворении повышают концентрацию собственных катионных частиц растворителя, являются кислотами, а те, которые увеличивают концентрацию анионных частиц растворителя, — основаниями.
Большинство химических реакций и изучение свойств многих веществ проводят в среде того или иного растворителя, поэтому важно знать свойства растворителя. Растворители, содержащие протоны и обладающие более или менее сильными кислотными свойствами, а также способные к ионизации, называются протонными растворителями. Для них характерен автопротолиз (Н., 0, H2S ()4 и т. д.). В протонных растворителях частицы растворяемого вещества окружены не только молекулами растворителя, но и катионами и анионами, образовавшимися при автонротолизе растворителя.
К так называемым апротонным растворителям относятся неполярные или слабо полярные недиссоциирующие жидкости, которые сольватируют слабо (СС14, CGH6 и др.); деионизированные, но сильно сольватирующие полярные растворители (диметилформамид, диметилсульфоксид и др.), а также сильно полярные аутоионизированные растворители (РОС13, BrF3 и др.).
Протолитическая теория значительно расширяет перечень кислот и оснований, однако и она имеет ряд недостатков, главный из которых — неспособность объяснить кислотно-основные свойства апротопных веществ.
Электронная теория Льюиса. Гилберт Ныотон Лыоис предложил более общее определение: кислота — это вещество, которое принимает электронную пару и является акцептором; основание — это вещество, которое предоставляет электронную пару и является донором.
Взаимодействие между кислотой и основанием согласно этому определению заключается в возникновении ковалентной связи по донорно-акцепторному механизму: 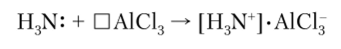
Аммиак, имеющий неноделенную пару электронов, является основанием, а координационно-ненасыщенная молекула А1С13 — кислотой.
На основании определений Лыоиса частицы типа NH3, CN, F", Cl", S03- и др. следует рассматривать как основания, а все ионы металлов — как кислоты. Степень сродства иона металла к лиганду называтся льюисовской кислотностью, а тенденция лиганда образовывать связи с ионом металла — льюисовской основностью. Силы кислот и оснований Льюиса могут меняться в зависимости от природы партнера.
В настоящее время электронная теория кислот и оснований является наиболее универсальной.