Ковалентные (молекулярные) галогениды

Большинство электроотрицательных элементов, а также металлы в высших степенях окисления образуют ковалентные галогениды. Эти соединения — либо газообразные, либо жидкие, либо легколетучие твердые вещества, молекулы которых удерживаются вместе благодаря вандерваальсовым силам. Считается, что существует взаимосвязь между увеличением ковалентности связи «металл — галоген» и повышением способности… Читать ещё >
Ковалентные (молекулярные) галогениды (реферат, курсовая, диплом, контрольная)
Большинство электроотрицательных элементов, а также металлы в высших степенях окисления образуют ковалентные галогениды. Эти соединения — либо газообразные, либо жидкие, либо легколетучие твердые вещества, молекулы которых удерживаются вместе благодаря вандерваальсовым силам. Считается, что существует взаимосвязь между увеличением ковалентности связи «металл — галоген» и повышением способности к образованию молекулярных соединений, поэтому их часто называют ковалентными галогенидами.
Важной особенностью строения ковалентных галогенидов является образование галогенидных мостиков между двумя или, реже, тремя другими атомами. Чаще всего между двумя атомами образуются мостики за счет двух атомов галогена, но известны соединения с одним и тремя мостиковыми атомами. Теория МО рассматривает связи во фрагменте Me — Hal — Me как трехцентровые четырехэлектронные (рис. 26.1).
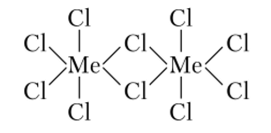
Рис. 26.1. Строение ковалентных галогенидов
Хлори бромсодержащие мостики имеют угловую структуру, a F-мостики могут быть изогнутыми и линейными.
Ионные галогениды, как правило, не подвергаются гидролизу, а ковалентные галогениды гидролизуются очень легко:
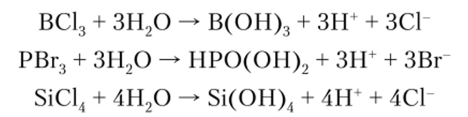
Такие галогениды, как SFG, СС14, очень устойчивы к воде и гидролизу не подвергаются. Это следствие влияния кинетических факторов.
При действии окислителей на галогениды наблюдаются те же закономерности, которые характерны для HHal.
Комплексные галогенид-анионы. Среди комплексных галогенид-анионов наиболее важные — фториды и хлориды. Они образуются при взаимодействии галогенида металла или неметалла, действующего в качестве кислоты Льюиса, с галогенид-ионом, который выступает как основание:
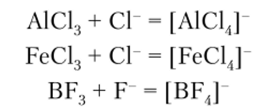
Большинство таких анионов может образоваться в водных растворах.
Комплексные соединения, образованные галогенид-ионами, характеризуются различной устойчивостью. Как правило, устойчивость понижается в ряду F — Cl — Br — I.
Комплексные галогенид-анионы образуются во многих реакциях, в которых принимают участие кислоты Льюиса, в частности А1С13 и BF3. Комплексные фториды весьма разнообразны. Для элементов второго периода координационное число по фтору равно 4, а для элементов остальных периодов оно равно 6. Известны также комплексные фториды, в которых координационное число центрального атома равно 7, 8, 9: KJBeFJ, K3[A1F6], K2[NbF7], K2[WF8], K2[ReF9|. Комплексные анионы фтора могут быть получены взаимодействием амфотерных фторидов с основными и кислотными фторидами:
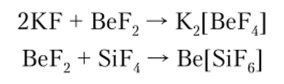
Комплексы типа [ЭНа14] имеют квадратную форму, что согласно теории МО отвечает двум взаимно перпендикулярным трехцентровым связям Hal —Э —Hal. Отрицательные ионы Вг" и I могут координировать вокруг себя нейтральные атомы галогенов, образуя комплексные ионы типа [Hal «-Hal®, получившие название полигалогениды или галогалогениды. Так, молекулярный 12, растворяясь в растворе KI, образует с ним комплексный дииодоиодат-ион:
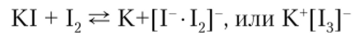
Координационная связь здесь относительно мало прочная, поэтому К[13] распадается на составные компоненты и указанная система находится в состоянии динамического равновесия, в связи с чем раствором 12 в KI можно пользоваться как свободным иодом. Известны и более сложные нолииодиды калия: К * 11″ • 1^ |, К * 11 • 18]".
Биологическая роль галогенов. Галогены в виде различных соединений входят в состав тканей человека и животных. Хлор и иод относятся к незаменимым элементам, а остальные являются постоянными составными частями тканей.
По содержанию в организме человека хлор (0,15%) относится к макроэлементам, в то время как остальные элементы этой группы являются микроэлементами (содержание ~10 5%).
В организме все галогены находятся в степени окисления -1, хлор и бром — в виде гидратированных ионов СГ и Вг", а фтор и иод — главным образом в связанной форме в составе некоторых биоорганических соединений.
Соединения фтора концентрируются в костной ткани, ногтях, зубах. В состав зубов входит около 0,01% фтора, причем большая часть приходится на эмаль, что связано с присутствием в ней труднорастворимого фторапатита Ca5(PO/i)3F. Недостаток фтора в организме приводит к кариесу зубов. Вреден не только недостаток, но и избыток фтора. При содержании фтора в питьевой воде выше предельно допустимой нормы (1,2 мг/л) зубная эмаль становится хрупкой, легко разрушается. Возникающее в этом случае заболевание называется флуорозом (фторозом).
Хлорид-ионы играют важную биологическую роль. Они активируют некоторые ферменты, создают благоприятную среду для действия протолитических ферментов желудочного сока, обеспечивают ионные потоки через клеточные мембраны, участвуют в поддержании осмотического равновесия.
Бром локализуется преимущественно в железах внутренней секреции, в первую очередь в гипофизе. Биологическая роль соединений брома в нормальной жизнедеятельности организма еще недостаточно выяснена. Имеются данные, что соединения брома угнетают функцию щитовидной железы и усиливают активность коры надпочечников. Бромид-ионы способствуют восстановлению нарушенного равновесия между процессами возбуждения и торможения.
Иод относится к числу незаменимых биогенных элементов, и его соединения играют важную роль в процессах обмена веществ. Имеются данные, что иод влияет на синтез некоторых белков, жиров, гормонов. Щитовидная железа способна концентрировать I в 25 раз по сравнению с содержанием его в плазме. Пониженная активность щитовидной железы (гипотиреоз) может быть связана с уменьшением ее способности накапливать иодид-ионы, а также с недостатком в пище иода (эндемический зоб).
Галогениды находят широкое применение в медицине и фармации.
Хлорид натрия (натрия хлорид) NaCl (поваренная соль) — см. параграф 13.4.
Хлорид калия КС1 (сильвин) применяют в качестве удобрения.
Хлорид кальция (кальция хлорид) СаС12 при получении кристаллизуется в виде гексагидрата СаС12-6Н20. При нагревании до 800 °C переходит в безводную соль, которая широко применяется для сушки различных химических соединений. СаС12 • 6Н20 гигроскопичен, на воздухе очень быстро поглощает влагу и расплывается. Хлорид кальция широко применяется в медицине как кровоостанавливающее средство, при аллергических заболеваниях, а также в качестве противоядия при отравлении солями магния.
Хлорид серебра AgCl применяется как светочувствительное вещество при изготовлении фотопленок, что основано на способности AgCl разлагаться под влиянием света с образованием свободного серебра.
Хлорид цинка ZnCl2 — ядовитое соединение. Применяется как средство, предохраняющее деревянные изделия от гниения, а также в целлюлознобумажной промышленности.
Бромид аммония (аммония бромид) NH4Br применяется, как и NaBr и КВг, при нервных расстройствах в качестве успокаивающего средства.
Иодид калия (калия иодид) KI получают взаимодействием Fel2 с иодом в щелочной среде:
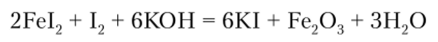
Раствор отделяют от оксида железа (Ш) и после упаривания кристаллизуют.
KI применяют для лечения глазных заболеваний — катаракты, глаукомы, при отравлениях солями ртути. В аналитической химии используют для приготовления индикатора — иодкрахмальной бумаги.