Титриметрический анализ.
Комплексонометрическое титрование
Пример 7.2 (прямое титрование). Концентрация рабочего раствора ЭДТА была установлена по раствору, содержащему в 1 л 24,00 мг Fc (NHf)(S04)2−12 Н, 0 (М = 482,91). На 10,00 мл этого раствора пошло 10,30 мл раствора ЭДТА. Рассчитаем нормальную концентрацию раствора ЭДТА. Очевидно, что независимо от заряда катиона образуются комплексы с соотношением компонентов 1:1, поэтому эквивалентная масса ЭДТА… Читать ещё >
Титриметрический анализ. Комплексонометрическое титрование (реферат, курсовая, диплом, контрольная)
Общая характеристика комплексонометрического титрования
Аминополикарбоновые кислоты и их производные образуют со многими металлами весьма прочные комплексы, в связи с чем они получили название комплексопов, а метод — комплексонометрического титрования.
Получили распространение следующие комплектны: нитрилотриуксусная кислота, или комплексон I, этилендиаминтетрауксусная кислота, или комплексон II.
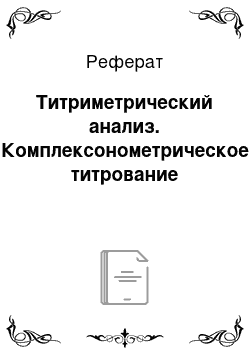
Вследствие низкой растворимости в воде сама кислота нс подходит для приготовления рабочего раствора. Наиболее широко применяют двунатриевую соль эгилендиаминтетрауксусной кислоты — комплексон III, или ЭДТА (торговое название — трилон Б), — Na2H2Y -2Н20. Взаимодействие ЭДТА с катионом металла идет по схеме.
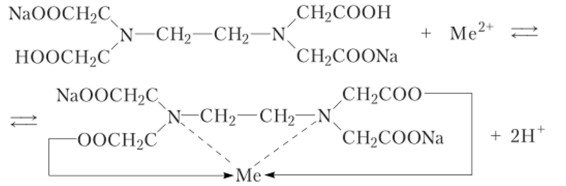
Реакции взаимодействия различных катионов с разной степенью окисления можно представить уравнениями.
Очевидно, что независимо от заряда катиона образуются комплексы с соотношением компонентов 1:1, поэтому эквивалентная масса ЭДТА и ионов металла равна половине молярной массы, а эквиваленты определяемого иона металла равны их молярным массам.
Пример 7.1. Рассчитаем эквивалентные массы Al3+, Са2+, Mg2*, Zr1+, Fe3+ при титровании их раствором ЭДТА.
Решение
Массы эквивалентов ионов будут равны молекулярным массам ионов: Э (А13+) = = 26,98; Э (Са2+) = 40,08; 3(Mg2+) = 24,32; 3(Zr4+) = 91,22; 3(Fe3+) = 55,85.
Комплексон III получил широкое применение в химическом анализе, потому что он образует внутрикомплексные соли как с катионами щелочноземельных металлов (Са2+, Mg2+, Ва2+), которые очень трудно перевести в комплексные соединения другими способами, так и практически со всеми катионами d-элементов.
Степень протекания реакции катионов металлов с ЭДТА зависит от pH раствора и константы нестойкости образующихся комплексов. Особенно заметно влияние кислотности при титровании катионов, образующих сравнительно малоустойчивые комплексы (Mg2+, Са2+ и др.): их можно оттитровать лишь в щелочной среде. Многие катионы титруются в присутствие аммиачного буферного раствора. Присутствие солей аммония в большинстве случаев предотвращает образование осадков малорастворимых гидроксидов металлов.
Образующиеся с ЭДТА комплексы d-элементов очень прочны. Ниже приведены значения рК комплексов ЭДТА (рК = -lg/CHecT) с некоторыми ионами металлов:
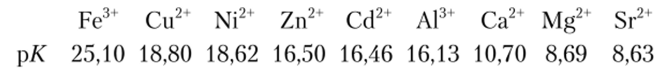
Такие катионы, как, например, Fe3~ (Кпест =10 2>), могут быть оттитрованы в кислом растворе.
Конечную точку титрования определяют с помощью металл-индикаторо в — органических веществ (которые можно рассматривать как слабые кислоты или основания), образующих с ионами металлов интенсивно окрашенные комплексы. Эти соединения, однако, менее прочны, чем комплексы тех же катионов с ЭДТА. Поэтому при титровании анализируемого раствора комплексоном III комплекс с индикатором разрушается и выделяется свободный индикатор, имеющий другую окраску.
Наиболее часто используют индикаторы хромоген и мурексид.
Хромоген черный Т (или эриохром) имеет разную окраску в недиссоциированном и ионном виде:

При pH = 7 11, когда индикатор имеет синий цвет, многие ионы металлов образуют комплексы красного цвета (Mg2+, Са2+, Zn2+, Cd2+, Al3+, Со2 Ni2+, Cu2+):

При добавлении ЭДТА появляется синяя окраска:
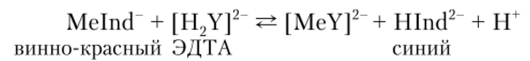
Мурексид при pH = 12 (в присутствии концентрированного NH^OH) с Са2+, Ni2+, Си2' и другими ионами образует комплексы красного цвета, которые под воздействием ЭДТА переходят в бесцветные | MeY|2, и при этом освобождается окрашенный ион Ind сине-фиолетового цвета:
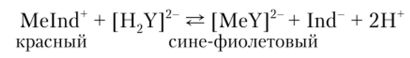
Индикаторы применяют в виде твердой сухой смеси с хлоридом натрия (химически чистым) в соотношении 1: 100 (по массе).
Существуют следующие методы комплексонометрического титрования:
- а) прямое титрование;
- б) обратное титрование (титрование по остатку);
- в) титрование заместителя, например Mg2+ дает менее устойчивые комплексы, чем другие ионы, поэтому Са2+ вытесняет его из комплекса с ЭДТА:
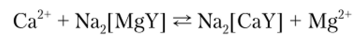
и его оттитровывают раствором ЭДТА.
Рассмотрим примеры расчетов при различных методах титрования.
Пример 7.2 (прямое титрование). Концентрация рабочего раствора ЭДТА была установлена по раствору, содержащему в 1 л 24,00 мг Fc (NHf)(S04)2-12 Н, 0 (М = 482,91). На 10,00 мл этого раствора пошло 10,30 мл раствора ЭДТА. Рассчитаем нормальную концентрацию раствора ЭДТА.
Решение. Имеем.
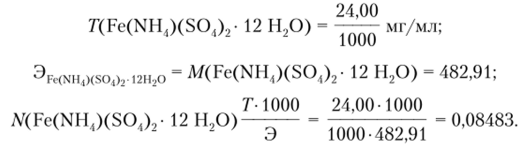
Но результатам титрования и по формуле закона эквивалентов PpV, = V2N2, где VtNt — объем и концентрация раствора Fe (NH4)(S04)2-12 H2C), a V2N2 — раствора ЭДТА, рассчитаем нормальную концентрацию раствора ЭДТА:
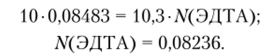
Пример 7.3 (титрование, но остатку). Для определения сульфат-иона навеску образца массой 1,5000 г растворили в 200 мл воды. Действием ВаС12 на 20,00 мл этого раствора получили осадок BaS04, который затем обработали 50,00 мл 0,0100 М раствора ЭДТА. Па титрование избытка ЭДТА в аммиачном растворе пошло 25,00 мл 0,0100 н раствора ZnSOj. Рассчитаем массовую долю (%) иона S04 (М = 96) в образце.
Решение. Имеем следующие реакции:

По исходным данным имеем: 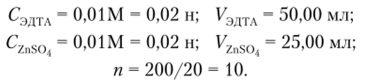
Тогда.
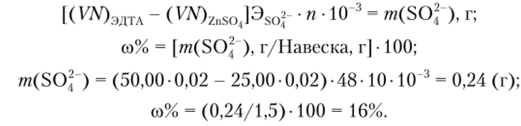
Пример 7.4 (титрование заместителя). При определении железа в пробе сточной воды объемом 200 мл, его окислили до Fe3 осадили NH4OH, отделили осадок от раствора и после растворения осадка в НС1 оттитровали Fe3', израсходовав 5,14 мл 0,0050 М раствора ЭДТА. Рассчитаем общую концентрацию железа в воде (мг/л).
Решение. Имеем следующие реакции:
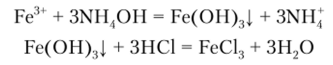
По исходным данным имеем:
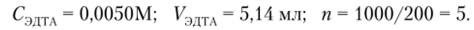
Тогда.
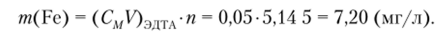
Пример 7.5 (титрование заместителя). Ионы серебра, содержащиеся в 25,00 мл пробы, связали в цианидный комплекс, добавив избыток раствора [Ni (CN) J2. Па титрование выделившихся ионов никеля израсходовали 43,70 мл 0.0240М раствора ЭДТА. Рассчитаем концентрацию серебра (г/л) в растворе пробы 0^=108).
Решение. Имеем следующие реакции:

Так как п = 1000/25 = 40, то имеем m (Ag), г = (ТМ)здта-МАй-«-10-3 = 43,7 0,0240−108−40−10 3 = 4,5308 г.
В табл. П6 приложения приведены металл-индикаторы для прямого титрования некоторых ионов металлов раствором ЭДТА.
Рабочие растворы ЭДТА можно готовить по точной навеске Na2H2Y-2H20 (А/ = 372,2). Соль должна иметь чистоту класса «ч.» или «ч.д.а.» и постоянную влажность (высушивают при 80°С),.
При отсутствии соли такой чистоты готовят приблизительно 0,1 М растворы и концентрацию раствора ЭДТА устанавливают титрованием.
Более разбавленные (0,01—0,05 моль/л) растворы получают разбавлением. Хранят их в полиэтиленовой посуде.
Установочными веществами могут служить СаС03, соли Zn, Mg, Ni, Pb, Cu; Zn металлический и др.