Электрохимическое взаимодействие сульфидных минералов

Последующая судьба ионов серы и S0 независимо от исходного окисляемого субстрата, вероятно, одинакова. По данным Г. И. Каравайко, В. Хазей и Х. Трибутш и Дж. Ройяс-Чапама, продукты реакции серных соединений в виде коллоидной серы отлагаются на поверхности клеток и поступают в периплазматическое пространство при окислении A. ferrooxidans S°, S2Ofy S4OI", S и FeS2, а также в клеточные стенки… Читать ещё >
Электрохимическое взаимодействие сульфидных минералов (реферат, курсовая, диплом, контрольная)
Руды и получаемые из них концентраты всегда представляют собой полиминеральные ассоциации. Сульфидные минералы в пульпе или рудах находятся в электрохимическом взаимодействии, т. е. между ними возникают гальванические токи. При этом окислительновосстановительные потенциалы (ОВП) отдельных минералов могут значительно отличаться от стационарных потенциалов, замеренных раздельно. В табл. 4.4 представлены ОВП ряда пар сульфид;
Таблица 4.4.
Величины Eh и ОВП при бактериальном окислении ассоциацией сульфидных минералов.
Минералы. | Eh среды, мВ. | ОВП минералов, мВ. |
CuFeS2 Cu2S, Cu5FcS4*. | 0,5 -0,7. | 0,4−0,5 0,3−0,4. |
FcAsS*. CuFcS2 | 0,77−0,8. |
|
CuFcS2 ZnS*. | 0,6−0,7. |
|
FeS2 CuFcS2*. | 0,6−0,7. |
|
* Минералы-аноды.
ных минералов. В смеси сульфидных минералов легче всего окисляется минерал с более низким ОВП, т. е. сульфид-анод, причем активность его окисления зависит от разности электродных потенциалов сульфида-анода и сульфида-катода.
Бактериальное окисление сульфидных минералов имеет ту же направленность, что и электрохимическое, однако значительно ускоряется микроорганизмами. Минералы-аноды окисляются в первую очередь. Это можно проиллюстрировать на примере окисления ассоциации минералов CuFeS2 (анод) и FeS2 (катод, рис. 4.4). Когда FeS2 и CuFeS2 были в контакте, первый минерал был пассивирован (катод), в то время как второй был корродирован (анод). Это гальваническое превращение ускоряется бактериями вследствие каталитического окисления как CuFeS2, так и Fe2* и серы, образующейся на поверхности халькопирита. В более сложной системе FeS2 — CuFeS2 и ZnS первые два минерала с более высоким электродным потенциалом окисляются слабо, выполняя функцию катода. Окислению подвергается ZnS (анод).
Химизм этих процессов представляется в следующем виде.
• Кислород восстанавливается на поверхности FeS2 (катод):

• CuFeS2 в первой системе окисляется как анод:

• Гальваническая реакция представляется уравнением:
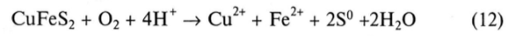
• Во второй системе ZnS окисляется как анод:

Электронтранспортная система бактериальной клетки действует как каталитический проводник при переносе электрона непосредственно из катодной зоны на поверхности сульфидного минерала на 02. Fe2* и 2S0 также окисляются бактериями по уже известным реакциям. Это приводит к созданию высокого Eh среды и разрушению пленки серы на поверхности минерала. Без бактерий в присутствии 02 как окислителя ток коррозии низкий. Он лимитируется анодным процессом, который приводит к образованию серы, пассивирующей поверхность сульфидных минералов. В присутствии Fe3+ без бактерий окислительные процессы вначале могут протекать активно, однако образование Fe2+ и S0 на поверхности минералов подавляет их дальнейшее окисление.
Итак, бактериально-химическое окисление сульфидных минералов осуществляется по законам электрохимической (коррозионной) модели, точнее — по законам биоэлектрохимии.
Механизм бактериального окисления Fez+, Sz~/S° и сульфидных минералов. Хемолитотрофные бактерии окисляют неорганические субстраты и получают энергию в соответствии с хемиосмотической теорией П. Митчела, а также по электрохимическим (коррозионным) механизмам.
Бактериальное окисление субстратов включает следующие стадии:
- 1) взаимодействие поверхностных структур бактерий с окисляемым субстратом (сорбция, адгезия);
- 2) изменение физико-химических свойств окисляемых субстратов и их транспорт в клеточную стенку;
- 3) окисление субстратов в поверхностных структурах клеток;
- 4) транспорт электронов и протонов; образование мембранного потенциала;
- 5) синтез АТФ и образование воды на внутренней поверхности цпм. 2+
Окисление Fe2 Окисление Fe2* грамотрицательным A. fer— rooxidans связано с его транспортом в периплазматическое пространство клетки, по-видимому, в комплексе с липополисахаридами, и функционированием электронтранспортной системы. Эта система включает: порин наружной мембраны (92 кДа), Fe ;

Рис. 4.5. Модель функционирования железоокисляющей системы A. ferrooxidans и транспорта электронов оксидазу (связанную с цитохромом с552); по крайней мере один с4-тип цитохрома с552, расположенный в периплазматическом пространстве; малый медьсодержащий белок (16 кДа) — рустицианин; терминальную цитохром с-оксидазу. Модель расположения в электронтранспортной цепи перечисленных компонентов показана на рис. 4.5.
При переносе электронов на ЦПМ возникает трансмембранный электрохимический градиент ионов водорода (Дцн*), который состоит из электрического (Ду) и химического компонентов (градиент концентраций Н+ — ДрН). Этот электрохимический потенциал обеспечивает синтез АТФ. Со второй половиной реакции окисления Fe2+ (26 + 2Н+ + У202 —> Н20) связан также механизм регуляции внутриклеточного pH, равного 6,5. Точная роль и расположение каждого компонента в электронтранспортной цепи, как отмечает Д. Роулингс, еще требует уточнений, и тут можно ожидать сюрпризов.
Очень мало известно относительно электронтранспортной системы грамотрицательных L.ferrooxidans. Первичные реакции акцептирования Fe, вероятно, идентичны A. ferrooxidans, а электротранспортная система отличается. У лептоспирилл отсутствует рустицианин, но есть растворимый красный цитохром. Эти бактерии, как уже отмечалось выше, окисляют только Fe2* и FeS2.
Окисление серы и сульфидных минералов. В сравнении с железоокисляющей системой A. ferrooxidans намного меньше известно о путях и компонентах, которые требуются для окисления серы, как элементной, так и сульфидной.
Японскими исследователями были открыты ферменты серо- (суль<1жд)-Ре3*-оксидоредуктаза (S° + 4FC3* + ЗН20 -э H2S03 + + 4Fei+ + 4Н+) и сульфит-Feоксидоредуктаза (H2S03 + 2FeJ* + + 4Н20 -" H2S04 + 2Fe?* + 2Н+).
У A. ferrooxidans, выращенного на сере, обнаружена сульфитцитохром с-оксидоредуктаза. A. thiooxidans, который окисляет только серные соединения, имеет мембраносвязанную сульфитоксидазу с большой молекулярной массой (400 кДа), сходную с сульфитFeоксидоредуктазой (650 кДа) A. ferrooxidans, выращенного на Fe2*. Как полагают Р. Манш и В. Санд, цитохромы b и ааъ являются частью сероокисляющей системы A. ferrooxidans. В окислении серы этим организмом, по-видимому, принимают участие терминальные оксидазы, поскольку этот процесс сильно ингибировали CN' и N3.
У L. ferrooxidans и грамположительных умеренно термофильных бактерий Т. Сугио и др. обнаружили серо (сульфид)-Feоксидоредуктазу. Однако сульфитFeоксидоредуктазная активность была низкая, a Feокисляющая активность намного чувствительней к игибированию сульфитом, чем у A. ferrooxidans. Этим, повидимому, объясняется невозможность L.ferrooxidans расти на сере.
И. А. Цаплина с соавт. изучили ферменты серного метаболизма у A.ferrooxidans, A. thiooxidans и сульфобацилл. Клетки A. ferrooxidans при росте на сере содержали 8°-диоксигеназу, тиосульфатдегидрогеназу, роданазу, АФС-ред^ктазу и сульфитоксигеназу. У сульфобацилл,окисляющих S4Oe и S° в миксотрофных условиях с Fe + и S20}, обнаружена активность таких ферментов, как тиосульфатокисляющий и тетратионатметаболизирующий ферменты, роданаза, АФС-редуктаза, сульфитоксидаза и §0-оксигеназа. Очевидно, пути окисления серных соединений у сульфобацилл близки к предложенному И. Сузуки для ацвдитиобацилл:

У ацидофильных грамотрицательных архей транспорт электронов осуществляется по вероятной схеме: Qca, —> цит. bj67 —" Rieske FeS —" цит. а583 —> цит. аа3 —> 02, а в основе синтеза АТФ лежит хемиосмотический механизм. Расположение ферментов в электронтранспортной цепи, очевидно, связано с мембраной.
Механизм первичных реакций окисления серы и сульфидных минералов сложный и требует их трансформации. Как уже отмечалось выше, бактерии, будучи в контакте с субстратом, изменяют его физико-химические свойства. Элементная сера растворяется в веществах липидной природы до коллоидного состояния и поступает в периплазматическое пространство, где и окисляется. В основе окисления сульфидных минералов, как уже известно, лежит биоэлектрохимический процесс. Прежде всего бактерии благодаря сорбции клеток и действию экзометаболитов на минералы изменяют их электродный потенциал, заряд, повышают электропроводность среды, создают высокий окислительно-восстановительный потенциал среды (> 700 мВ), создают определенную разность потенциалов между минералом и средой-электролитом и т. д. В результате биоэлектрохимических процессов на поверхности сульфида-анода в диффузионном слое, измеряемом ангстремами, появляются ионы Fe'f и S2~/S°, т. е. бактерии и в случае сульфидов фактически при их окислении имеют дело с Fe2+, S2" /S°. Далее Fe окисляется по вероятной схеме (см. рис. 4.5).
Последующая судьба ионов серы и S0 независимо от исходного окисляемого субстрата, вероятно, одинакова. По данным Г. И. Каравайко, В. Хазей и Х. Трибутш и Дж. Ройяс-Чапама, продукты реакции серных соединений в виде коллоидной серы отлагаются на поверхности клеток и поступают в периплазматическое пространство при окислении A. ferrooxidans S°, S2Ofy S4OI" , S и FeS2, а также в клеточные стенки сульфобацилл и архей. Очевидно, ведущую роль в этом процессе играют не строение клеточной стенки, а ее биохимические особенности. Механизм дальнейшего окисления серных соединений и синтез АТФ, очевидно, единый у всех хемолитотрофов. Транспорт электронов по весьма различным электронтранспортным цепям у грамотрицательных и грамположительных бактерий и архей приводит к возникновению трансмембранного электрохимического потенциала, благодаря чему происходит синтез АТФ.
Влияние технологических условий. Размеры частиц и плотность пульпы. Размеры частиц руды или концентрата определяют площадь их поверхности, от которой зависит адгезия бактерий и скорость окислительных процессов. Наибольшая скорость окисления сульфидов в пульпе A.ferrooxidans при чановом выщелачивании наблюдается при размерах частиц от 2 — 3 до 40 мкм, однако в промышленных условиях обычно используются частицы флотационного концентрата размером ~ 74 мкм. Изменение размера частиц от 159 до 29,5 мкм ускоряло окисление FeS2 ‘S', metallicus от 0,05 до 0,098 кгм~3-ч_|. Частицы меньше 0,2 мкм повреждали структуру клетки, и FeS2 не окислялся.
При кучном и подземном выщелачивании металлов тонкое измельчение руды невозможно, так как с крупностью материала в тесной связи находится водопроницаемость и аэрация руды. Для определения кинетических параметров выщелачивания металлов в перколяторах руду дробят до размеров кусков 13 мм. При кучном выщелачивании дробление осуществляется в дробильной установке, а при подземном — буровзрывными работами.
Плотность пульпы (соотношение твердого вещества к жидкому) при чановом выщелачивании зависит от типа концентрата или промпродукта. Переработку цинксодержащих продуктов мезофильными бактериями можно проводить при плотности пульпы 16 —40%, медных концентратов — до 30%. Вскрытие золота в золото-мышьяковых концентратах эффективно проводится при плотности пульпы до 20%. На скорость окисления FeS2 S.metallicus (68 °С) не оказывала влияния плотность пульпы до 12%. При более высокой плотности окисление FeS2 было слабым. Сульфобациллы в плотной пульпе (20% твердого вещества) при температуре выше 42 °C погибают.
Влияние химических элементов. Токсичность металлов для бактерий зависит от физиологического состояния бактерий, химического состояния металлов и степени их взаимодействия в среде. Здесь нужен системный подход. Активность A.ferrooxidans в пульпах определяется комплексом ионов металлов, а не каждым из них. К наиболее токсичным катионам относят Cd, Ag, Hg и U. Анионы Se,.
Те, As и Мо более токсичны, чем большинство катионов металлов. Калий снижал токсичность серебра. При развитии A.ferrooxidans на сере и сульфидах устойчивость его к Ag+ значительно возрастала. Это объясняется высоким сродством Ag+ к сере. Токсичность Zn, Ni и Со снижалась при развитии A.ferrooxidans на сере и возрастала на среде с S2O3″. Добавление в среду 100 — 200 мМ Zrf+, Ni Mg"* или Мп2+ частично снижало токсичность 1Ю2, при концентрации этих катионов 2 — 20 мМ токсичность уран ил сульфата не снижалась. Ингибирование роста A.ferrooxidans в присутствии 0,7 г/л уранилсульфага частично снижается в присутствии 200 мМ К*, Na*, Lf или NH4+ в виде сульфатов. Zn снижал токсичность меди. Токсичность металлов снижается в присутствии комплексующих агентов. Например, добавление цистеина (10-4 М) предотвращало ингибирование A. ferrooxidans Ag+. Ионы Те04, W04~, As04 или Р04 стимулировали окисление Fc2+ A. ferrooxidans в присутствии S04~ или Se4~ и не действовали без них. В целом же A.ferrooxidans высокоустойчив к отдельным металлам: Си — 50 г/л; Zn — 70 мг/л; Со — 30 г/л; As — 6— 10 г/л; Мо — 200 мг/л; А1 — 20 r/л; Ni — 72 г/л; Ag — 1,0 — 10 мг/л; Cd — 120 мг/л; U308 — 12 г/л. L. ferrooxidans более резистентный, чем A.ferrooxidans к урану и Fe, но более чувствителен к Си2+ и мышьяку. Резистентность других хемолитотрофов к металлам изучена недостаточно.
Источники питания. Важнейшими элементами для жизнедеятельности хемолитотрофных бактерий в биогидрометаллургии являются азот и фосфор. Как при чановом, так и при кучном и подземном выщелачивании металлов другие необходимые для бактерий элементы поступают из руды или концентратов. Азот и фосфор обычно либо отсутствуют, либо присутствуют в низких количествах, причем они постоянно выводятся из среды, вступая в реакции с другими элементами с образованием фосфатов железа, ярозита и т. д., и поэтому требуется их постоянное добавление. С солями азота и фосфора поступает и калий. Лабораторные и промышленные испытания показали возможность использования в качестве источника азота и фосфора аммофоса (удобрение) с массовой долей азота — 11 — 13% и усвояемых фосфатов — 49 — 51%. При замене в традиционных средах солей азота, фосфора и калия на аммофос снижается их стоимость в 10 раз без изменения или даже при увеличении кинетических параметров окисления Fe2+, S° и сульфидных минералов в пульпе.