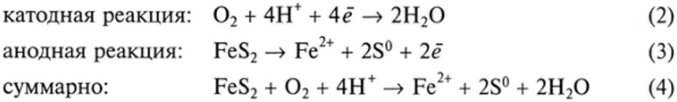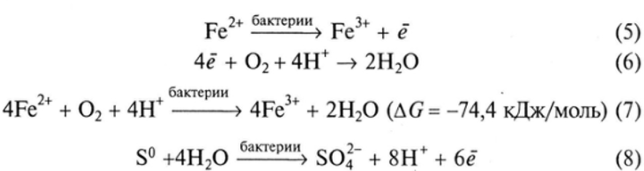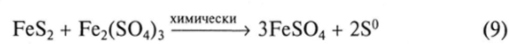Основными физико-химическими факторами при кучном, подземном и чановом выщелачивании меди, цинка, никеля, урана являются pH, Eh, температура, наличие кислорода, ионов сернокислого оксидного железа (Fe3+) и т. д. Они в той или иной степени определяются типом руды, степенью ее окисления и проницаемостью, а следовательно, и характером складирования, габаритами отвалов, способом подготовки руды или рудного тела к выщелачиванию на месте залегания и т. д. От совокупности благоприятных факторов (pH 1,2—2,0; Eh 700 мВ, и др.) зависит активность сообщества бактерий, окисляющих сернокислое закисное железо (Fe серу (S°, S2+) и сульфидные минералы.
Химические реакции, которые происходят в процессе бактериального окисления, могут быть показаны на примере окисления пирита:
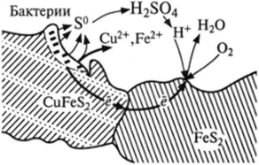
Бактерии воздействуют на сам минерал, будучи в контакте с ним и экзометаболитами (рис. 4.4), создавая его электродный потенциал, заряд и т. д. и тем самым ускоряя биоэлектрохимическое окисление минерала. Пирит в этой паре занимает позицию катода, а халькопирит — анода, имея более низкий окислительно-восстановительный потенциал. Образующиеся продукты этой реакции (Fe2+, S° и др.) окисляются бактериями до конечных продуктов:
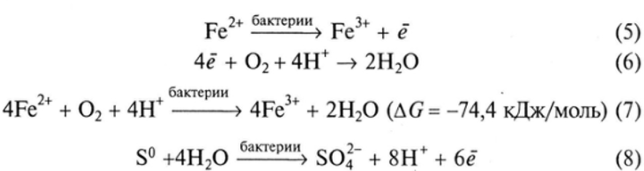
Рис. 4.4. Схематическое изображение модели гальванического превращения CuFeS2|FeS2-cncTeMbi в кислородной среде.
Аналогичный механизм окисления характерен и для других сульфидных минералов. Образующийся Fe3* также является окислителем многих сульфидных минералов:
Продукты этой и подобных ей реакций окисляются бактериями до Fe3+ или H2S04. Таким образом, эти бактериально-химические процессы едины и создают низкую величину pH, высокий окислительно-восстановительный потенциал среды, необходимую концентрацию Fe3* и обеспечивают активные процессы выщелачивания металлов из руд. Следует отметить особые окислительные свойства Fe34 в кислой среде в отношении вторичных сульфидных минералов меди, цинка и некоторых минералов никеля.