Адсорбция.
Процессы и аппараты защиты окружающей среды

Если в неподвижном слое практически весь процесс массообмена происходит в зоне массопередачи, которая перемещается с постоянной скоростью вдоль слоя, то при адсорбции в движущемся слое можно считать, что слой адсорбента перемещается навстречу потоку газа со скоростью, равной скорости движения зоны массопередачи. При этом зона массопередачи может рассматриваться как неподвижная относительно стенок… Читать ещё >
Адсорбция. Процессы и аппараты защиты окружающей среды (реферат, курсовая, диплом, контрольная)
Основы процесса физической адсорбции
Физическая адсорбция обусловлена взаимным притяжением молекул сорбтива под действием сил Вап-дер-Ваальса и не сопровождается химическим взаимодействием адсорбированного вещества с поглотителем. В процессе адсорбции предельным состоянием для каждого поглощенного вещества является состояние равновесия между концентрацией в адсорбенте «о и парциальным давлением р адсорбированного вещества в парогазовой смеси. Кривая равновесия при постоянной температуре а{) = f (p) называется изотермой адсорбции и служит основной характеристикой статики процесса. Между концентрацией су адсорбируемого вещества в газовой смеси и его парциальным давлением р, согласно уравнению Клапейрона, существует зависимость.

Согласно теории Эйкена и Поляни, располагая изотермой адсорбции пара стандартного вещества для температуры 7), можно вычислить изотерму адсорбции другого при температуре Т2.
Величины адсорбции находят по формуле 
где а 1 и а2 — ординаты изотермы соответственно стандартного (обычно бензола) п исследуемого вещества, кг/кг или кмоль/г; V] и Vo — молярные объемы стандартного исследуемого вещества, м .
Молярные объемы определяют по формуле.

где М — молекулярная масса, кг/кмоль; с — плотность жидкости, кг/м3.
Давление находят из выражения.
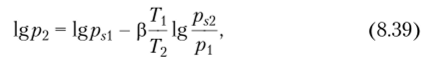
где ]>, р2 — парциальные давления стандартного и исследуемого вещества, кПа; ps2 — давление насыщенного пара исследуемого вещества при температуре 1, кПа; Р — коэффициент аффинности, равный отношению молярных объемов:

Коэффициент аффинности рдля некоторых веществ приведен в табл. 8.3 (в качестве стандартного принят бензол).
При расчете точек изотермы исследуемого пара координаты Q и р берутся по кривой стандартного вещества, а значения р, ръ ps, ps2 — из таблиц давления насыщенного пара. Обычно изотерму адсорбции при периодическом процессе можно разделить на три области: первая характеризуется отклонением — < 0,17 (по бензолу); для второй — ~ 0,17—0,5;
Ps Ps
" р _.
для третьей — < 0,5.
Ps
Для первой области, где изотерма адсорбции считается прямолинейной, можно пользоваться формулой.
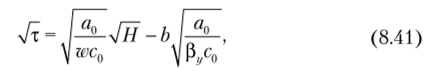
где т — продолжительность адсорбции, с; w — скорость парогазового потока, отнесенная к полному сечению аппарата, м/с; II — высота слоя адсорбента; с$ — начальная концентрация адсорбированного вещества в парогазовом потоке; а0 — количество адсорбируемого вещества, равновесное с концен;
Таблица 83
Коэффициент аффинности Р.
Вещество. | Р. | Вещество. | Р. |
Метиловый спирт. | 0,40. | Уксусная кислота. | 0,97. |
Бромистый метил. | 0,57. | Бензол. | 1,00. |
Этиловый спирт. | 0,61. | Циклогексан. | 1,03. |
Муравьиная кислота. | 0,70. | Четыреххлористый углерод. | 1,05. |
Сероуглерод. | 0,76. | Диэтиловый эфир | 1,09. |
Хлористый этил. | 0,78. | Пентан. | 1,12. |
Пропан. | 0,86. | Толуол. | 1,25. |
Хлороформ. | 0,88. | Хлорпикрин. | 1,28. |
Ацетон. | 0,90. | Гексан. | 1,35. |
Бутан. | 0,94. | Гептан. | 1,59. |
трацией потока с0 (кг/м3), берется по изотерме адсорбции в (кг/кг) и умножается на насыпную плотность адсорбента (кг/м3); ру — коэффициент массоотдачи, с-1; величина коэффициента b берется для значений с/сц из приведенных в табл. 8.4 данных, где с — содержание адсорбируемого вещества в газовом потоке, выходящим из адсорбера.
Таблица 8.4
Значение коэффициента b
с/с0 | ь | с/с0 | Ъ |
0,05. | 1,84. | од. | 0,23. |
0,01. | 1,67. | 0,5. | 0,09. |
0,03. | 1,35. | 0,6. | — 0,10. |
0,05. | 1,19. | 0,7. | — 0,27. |
0,1. | 0,94. | 0,8. | — 0,46. |
0,2. | 0,63. | 0,9. | — 0,68. |
0,3. | 0,42. |
Для второй области изотермы адсорбции применяют уравнение.
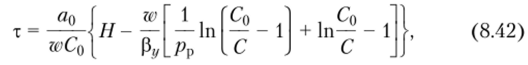
где р? = со/с*; с* — содержание вещества в газовом потоке, равновесное с половинным количеством, от максимально адсорбируемого данным адсорбентом, кг/м3.
Для третьей области изотермы адсорбции:
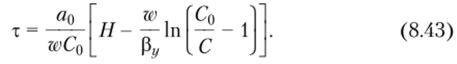
Теплота адсорбции, как известно, складывается из теплоты конденсации и теплоты смачивания. Практически можно принять, что величина теплоты адсорбции органических веществ не зависит от температуры. Зависимость удельной теплоты адсорбции q (Дж/кг) адсорбента от количества поглощаемого пара определяется по формуле.

где а — количество адсорбируемого пара, дм3/кг; т, п — константы, значения которых представлены в табл. 8.5.
При адсорбции водяного пара углем теплота адсорбции зависит от температуры следующим образом: при температуЗначения т, п
Вещество. | Формула. | п | яг-10-3 |
Бензол. | с6н6 | 0,959. | 3,24. |
Бромистый этил. | С2Н5Вг. | 0,960. | 3,77. |
Диэтиловый эфир | (С2н5)2о. | 0,922. | 3,84. |
Сероуглерод. | cs2 | 0,921. | 3,15. |
Хлороформ. | СНС13 | 0,935. | 3,47. |
Четыреххлористый углерод. | СС14 | 0,930. | 3,74. |
Этиловый спирт. | С2Н5ОН. | 0,928. | 3,65. |
ре 10 °C теплота адсорбции q = 14 900−103 Дж/кг; при температуре 40 °C теплота адсорбции q = 39 000−103 Дж/кг; при температуре 80 °C теплота адсорбции q = 34 800−103 Дж/кг; при температуре 128 °C теплота адсорбции q = 30 900−103 Дж/кг; при температуре 187 °C теплота адсорбции <7 = 2 1 800−103 Дж/кг.
Поглощение газов и паров, как правило, проводится в динамических условиях — из потока газа-носителя. В этом случае слой сорбента характеризуется величиной динамической адсорбционной активности ад — количеством поглощенного вещества (сорбтива) слоем адсорбента до момента появления за слоем притока сорбтива:

где йд — динамическая адсорбционная активность слоя адсорбента, кг/м3; Со — исходная концентрация сорбтива в газовом потоке, кг/м, w — скорость парогазовой смеси, отнесенная к полному сечению аппарата, м/с; х — время защитного действия, с.
Как было показано выше, объемный коэффициент массопередачи определяется по уравнениям (8.15), (8.16).
В зависимости от скорости парогазовой смеси, формы изотермы адсорбции, размера, формы и укладки зерен адсорбента, концентрации адсорбтива, а также других условий проведения процесса в неподвижном слое адсорбента определяющее влияние на общую скорость адсорбции может иметь скорость внешнего массопереноса (характеризуемая величиной рyv) или скорость внутреннего массопереноса. Очень часто влияние внешнеи внутридиффузионного сопротивления на величину Куу соизмеримо, причем их относительное влияние изменяется по длине зоны массопередачи.
В качестве критерия оценки преобладающего влияния внешней или внутренней диффузии на массообмен при адсорбции может служить величина диффузионного критерия Био (Bi). Так, при Bi > 30 скорость внешнего массопереноса настолько велика, что скорость процесса в целом определяется скоростью диффузии внутри зерна адсорбента, а при Bi <0,1 общая скорость процесса лимитируется скоростью внешней диффузии в газовой (жидкой) фазе.
Обычно учесть количественно с достаточной точностью влияние каждого из составляющих процессов массоотдачи на общую скорость адсорбции весьма затруднительно. В связи с этим большинство расчетных зависимостей для Kl/V получено для условий, когда скорость внутренней массоотдачи настолько велика, что величиной т/$уу можно пренебречь и принять Куу ~ руу. Величина Рху в противоположность $уу практически не зависит от гидродинамического режима движения потока через адсорбент, зато она резко снижается с увеличением концентрации адсорбтива в адсорбенте и при увеличении степени насыщения адсорбента составляет все возрастающую долю от общего диффузионного сопротивления.
В расчетах обычно принимается, что коэффициент массопередачи KyV остается постоянным по всей длине работающего слоя адсорбента и не зависит от степени его насыщения.
Если в неподвижном слое практически весь процесс массообмена происходит в зоне массопередачи, которая перемещается с постоянной скоростью вдоль слоя, то при адсорбции в движущемся слое можно считать, что слой адсорбента перемещается навстречу потоку газа со скоростью, равной скорости движения зоны массопередачи. При этом зона массопередачи может рассматриваться как неподвижная относительно стенок адсорбера. Отсюда следует, что условия массопередачи в неподвижном и движущемся слоях адсорбента аналогичны и для расчета массопередачи в этих процессах применимы одни и те же расчетные зависимости.