Химические свойства кислорода и озона

При обычных условиях химическая активность кислорода невелика. Это чрезвычайно важно для существования жизни. Все органические вещества, в том числе и входящие в состав живых организмов, способны окисляться кислородом до углекислого газа и воды. Если бы эти реакции шли быстро, то жизнь в кислородной атмосфере была бы невозможна. На самом деле кислород не только не убивает живые организмы… Читать ещё >
Химические свойства кислорода и озона (реферат, курсовая, диплом, контрольная)
Кислород образует соединения почти со всеми химическими элементами. Большинство кислородных соединений весьма устойчиво. Химические связи кислорода с тем или иным элементом оказываются, как правило, прочнее связей тех же элементов с другими атомами. Результатом этого является возможность протекания реакций горения, при которых все связи в исходном веществе заменяются на связи с кислородом — образуются оксиды. Кислород действует как окислитель по отношению ко всем элементам, кроме фтора.
Пример 19.1. Какие из следующих веществ способны реагировать с кислородом: Al, С, С02, СО, Na2S03, Fe (OII)2, H2S04, III, CaF2, NH3, C2H5OH, NaCl?
Решение. Среди приведенных веществ только углекислый газ и серная кислота содержат элементы в высших степенях окисления. Они связаны с кислородом и далее реагировать с ним не могут. Фторид кальция не реагирует с кислородом, так как последний не вытесняет фтор. Хлорид натрия также не реагирует с кислородом, так как хлор не дает прочных связей с кислородом. В остальных веществах атомы могут образовать связи с кислородом и реагируют с ним.
При обычных условиях химическая активность кислорода невелика. Это чрезвычайно важно для существования жизни. Все органические вещества, в том числе и входящие в состав живых организмов, способны окисляться кислородом до углекислого газа и воды. Если бы эти реакции шли быстро, то жизнь в кислородной атмосфере была бы невозможна. На самом деле кислород не только не убивает живые организмы, но и необходим для них. Он окисляет глюкозу, продукты расщепления жиров и некоторые другие вещества, служащие источниками энергии для жизнедеятельности клеток. Но идут эти реакции только при участии имеющихся в клетках белковых катализаторов — ферментов.
Реакции кислорода могут идти в форме горения и окисления. Горение — это быстрая реакция, сопровождающаяся большим выделением энергии. Температура, необходимая для непрерывного процесса горения, поддерживается выделяющейся при реакции теплотой. Скорость горения зависит от содержания кислорода в газовой смеси. Известно, что тлеющий на воздухе уголь ярко загорается в кислороде. Это очевидный признак увеличения скорости реакции. Ускорить реакцию горения можно как использованием обогащенной кислородом смеси, так и принудительной подачей обычного воздуха в зону горения. Это было известно уже в древности. Металлурги нагнетали воздух в печи с помощью мехов.
Одна из тщательно изученных реакций горения — это горение водорода в кислороде. При поджигании смеси этих газов — гремучего газа — происходит взрыв, а при смешивании газов в зоне горения возникает очень горячее пламя с температурой до 3000 °C. Водородные горелки применяются для сварки тугоплавких сплавов, для стеклодувных работ с кварцевым стеклом.
При инициировании горения водорода, т. е. поджигании смеси, образуются свободные радикалы в результате элементарных превращений типа.
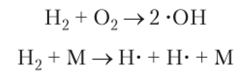
В последней реакции М — это любая частица, в результате соударения с которой молекула водорода распадается на атомы. Далее радикалы реагируют с молекулами, продолжая цепь превращений:
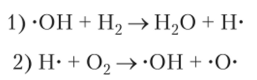
В реакции (2) образуется радикал кислорода с двумя неспаренными электронами. Он порождает еще два радикала: 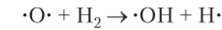
Один радикал, участвующий в реакции (2), дает фактически три новых радикала. Цепь разветвляется, и идет лавинообразное ускорение реакции. Такая реакция носит название разветвленной цепной реакции. В этой реакции, так же как и в реакции водорода с хлором, возможен обрыв цепей в результате рекомбинации радикалов и соударения их с неактивными частицами и со стенкой сосуда. Рекомбинация двух радикаловОН приводит к образованию молекул перекиси водорода, которая образуется как примесь к воде в количестве около 1%.
Обычно как кислород 02, так и озон окисляют вещества до одних и тех же конечных продуктов, но озон реагирует во много раз быстрее. Подкисленный раствор иодида калия постепенно желтеет вследствие окисления Р кислородом и выделения иода. Озон с тем же раствором реагирует очень быстро:
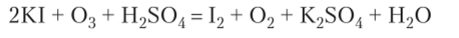
Эта реакция применяется для качественного и количественного определения озона.
В большинстве химических реакций с простыми и сложными веществами кислород 02 восстанавливается до степени окисления -2. Однако есть необычные реакции. С некоторыми активными металлами (натрий, барий) и их оксидами кислород образует пероксиды, содержащие ион 02; в котором атомы кислорода соединены между собой и имеют степень окисления -1:
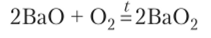
При гидролизе пероксида бария образуется перекись водорода:
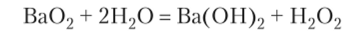
Еще более необычно реагирует кислород с калием. Последний легко отдает электрон, присоединяющийся к молекуле кислорода без нарушения ее целостности:
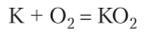
Образуется супероксид калия, вещество желтого цвета, содержащее ион О 2— Строение его можно понять исходя из уточненной структурной формулы кислорода (см. выше). Дополнительный электрон заселяет одну из разрыхляющих орбиталей, образуя электронную пару с имеющимся электроном:
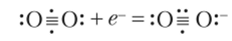
В особых условиях в реакциях с соответствующими реагентами молекула кислорода может нс только присоединить, но и отдать один электрон с разрыхляющей орбитали. При изучении гексафторида платины PtF6 было обнаружено, что э го вещество, темный коричнево-красный газ, обладающее исключительно высоким сродством к электрону, реагирует с кислородом, образуя оранжевое кристаллическое вещество 02+[PtF6]. Кислородный катион в составе этого вещества называется диоксигенил. Его электронная структура легко выводится из структуры молекулы кислорода:
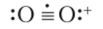
Рассматривая последовательность из диоксигенил-иона, молекулы кислорода и супероксид-иона, мы видим частицы, имеющие один, два и три электрона на разрыхляющих орбиталях. Эти электроны понижают прочность молекулы, уменьшая кратность связи от 2,5 в диоксигенил-ионе до 1,5 в супероксид-ионе. Соответственно возрастают межъядерные расстояния:
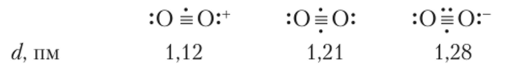
Успешное объяснение структуры этих частиц на основе ММ О показывает принципиальную справедливость данного подхода к пониманию природы химической связи.