Элементы группы viia — галогены

В таблице Менделеева каждый галоген является предпоследним элементом своего периода. Следом за ним стоит благородный газ. Это значит, что до завершенной устойчивой электронной структуры у атома галогена недостает только одного электрона. Поэтому галогены характеризуются ярко выраженными неметаллическими свойствами. Во внешних электронных оболочках их атомов имеется по семь электронов: Остальные… Читать ещё >
Элементы группы viia — галогены (реферат, курсовая, диплом, контрольная)
Изучив содержание главы 18, студенты должны: знать
- • положение галогенов в таблице Менделеева, нахождение в природе и практическое применение;
- • строение атома, валентность, степени окисления галогенов;
- • способы получения и свойства простых веществ;
- • основные типы соединений галогенов; уметь
- • составлять уравнения реакций получения галогенов и реакций, характеризующих химические свойства галогенов;
- • проводить сопоставление свойств элементов в группе галогенов;
- • характеризовать практически важные соединения галогенов;
- • проводить расчеты, но уравнениям реакций, в которых участвуют галогены; владеть
- • навыками прогнозирования протекания реакций с участием галогенов и их соединений.
Строение атомов. Распространенность галогенов в природе
Химические элементы VIIA-грунпы от фтора до иода получили общее название галогены (от греч. «галос» — соль, «генос» — порождающий) из-за их способности образовывать бинарные соли с металлами. В группу галогенов входит также радиоактивный элемент астат. Нуклид 2^At образуется в цени радиоактивного распада 2^|U Период полураспада 2j$At составляет всего 8,1 ч. Этот элемент остается малоизученным. Хлор и бром имеют по два устойчивых изотопа:С1, ^С1, ЦВг и 35В1*. Наличие изотопов у хлора обнаруживается по средней атомной массе, отклоняющейся от целого числа. У брома в природе почти равное содержание изотопов, и атомная масса оказывается средней между 79 и 80 (см. таблицу Менделеева). Фтор и иод представляют собой одиночные нуклиды и ^р.
В таблице Менделеева каждый галоген является предпоследним элементом своего периода. Следом за ним стоит благородный газ. Это значит, что до завершенной устойчивой электронной структуры у атома галогена недостает только одного электрона. Поэтому галогены характеризуются ярко выраженными неметаллическими свойствами. Во внешних электронных оболочках их атомов имеется по семь электронов: 
Атомы галогенов характеризуются одновременно большой энергией ионизации и энергией сродства к электрону. Поэтому у галогенов высокая электроотрицательность. Фтор оказывается элементом с самой высокой относительной электроотрицательностью х = 4. Связи галогенов с металлами имеют преобладающий ионный характер. Вследствие этого большинство галогенидов металлов образуют ионные кристаллические структуры и являются солями.
Для галогенов наиболее характерно одновалентное состояние, причем фтор всегда только одновалентен. Остальные галогены в соединениях с кислородом и фтором проявляют и другие валентности. Это объясняется наличием в их атомах свободных rf-орбиталей, с участием которых возникают возбужденные состояния атомов. Например, при переходе одного, двух или трех электронов хлора на свободные ^/-орбитали число неспаренных электронов каждый раз возрастает на два. Атом хлора становится трех-, пятиили семивалентным:
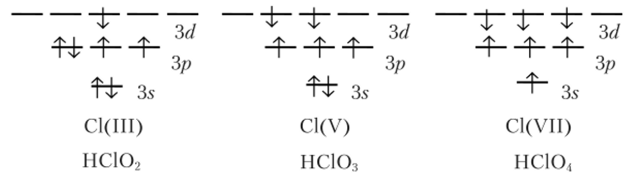
Остальные элементы, кроме кислорода и фтора, не способны стабилизировать высшие валентности хлора и брома. Только иод переходит в трехвалентное состояние при реакции с хлором, образуя 1С13.
В земной коре (вместе с океаном) наиболее распространены фтор и хлор. Их массовая доля составляет около 0,01%. Фтор встречается в виде практически нерастворимых минералов флюорита CaF2, фторапатита Ca5(P04)3F, криолита Na3AlF6. Все они имеют важное хозяйственное значение. Для хлора характерно образование растворимых солей. Он встречается в виде хлорида натрия как в природных водах (океаны, моря, соляные озера, источники подземной воды), так и в твердых залежах — минерал галит. Вода океанов содержит в среднем 1,8% хлора. Это неисчерпаемые и легко доступные запасы хлора. Есть также залежи хлорида калия (сильвин) и смеси хлоридов натрия и калия (сильвинит). Минерал карналлит состоит из хлоридов калия и магния — KCl-MgCl2-61120. Бром постоянно сопровождает хлор в тех же водах и минералах, но его содержание в среднем в 300 раз меньше. Добывают бром из некоторых водных бассейнов с большим содержанием солей (Мертвое море, озеро Саки в Крыму и др.). Содержание иода в природе в 1000 раз меньше, чем хлора. Источником получения иода служит вода нефтяных скважин и морские водоросли, концентрирующие иод из окружающей среды. Это единственный из галогенов, который в природе может окисляться кислородом до простого вещества 12, и его присутствие в воздухе обнаруживается, но запаху местами на побережьях морей.
Галогены имеют жизненно важное значение. Фтор как микроэлемент в виде фторапатита Ca5(P04)3F входит в состав зубной эмали, а различные другие соединения фтора применяются для профилактики зубных заболеваний. Образуя нерастворимый в воде фторид кальция, фтор в значительном количестве — от 0,2 до 1% — накапливается в костях. Общее содержание фтора в организме человека составляет в среднем 2,6 г. Хлор — необходимый для жизни макроэлемент. В организме человека его около 100 г. Хлор находится в биологических жидкостях в виде растворимых солей натрия, калия и др. Его роль заключается в обеспечении необходимой концентрации этих катионов. Ионы хлора безвредны. Но никоим образом нельзя назвать безвредными простое вещество С12, а также кислородные и органические соединения хлора. Вдыхание воздуха, содержащего значительную примесь С12, вызывает тяжелое поражение легких. Органические соединения хлора при попадании в организм вызывают поражения печени, нервной ткани и др. Биологическая роль брома окончательно не установлена. Однако известно, что соединения брома проявляют успокаивающее действие и широко применяются в лекарственных препаратах. Иод — биогенный микроэлемент, содержащийся в организме человека в количестве около 13 мг. Иод сильно концентрируется в щитовидной железе. В гормонах щитовидной железы иод образует ковалентную связь с углеродом. Недостаток иода вызывает заболевание щитовидной железы (зоб). В этом случае больных лечат препаратами, содержащими иод, например назначают прием иодида калия.