Гидратация ионов в растворе

Современные воззрения на процесс электролитической диссоциации объединяют идеи Аррениуса о диссоциации электролитов при растворении и учение Д. И. Менделеева о растворе как о химической системе — продукте взаимодействия растворенного вещества и растворителя. Свою точку зрения на природу растворов Менделеев кратко сформулировал следующим образом: «Растворы представляют жидкие диссоциационные… Читать ещё >
Гидратация ионов в растворе (реферат, курсовая, диплом, контрольная)
Современные воззрения на процесс электролитической диссоциации объединяют идеи Аррениуса о диссоциации электролитов при растворении и учение Д. И. Менделеева о растворе как о химической системе — продукте взаимодействия растворенного вещества и растворителя. Свою точку зрения на природу растворов Менделеев кратко сформулировал следующим образом: «Растворы представляют жидкие диссоциационные системы, образованные частицами растворителя, растворенного тела и тех определенных нестойких, но экзотермических соединений, которые между ними происходят, одного или нескольких, смотря по природе составляющих начал».
Как показано в гл. 7, источник энергии, необходимой для разрушения связей в растворяемом веществе — ионном или молекулярном, — это взаимодействие растворенного вещества с растворителем, сольватация растворенного вещества и образование тех соединений, о которых говорил Менделеев. В результате сольватации образуются сольватированные ионы (катионы или анионы), каждый из которых включает соответствующий ион и окружающую его сольватную оболочку, состоящую из молекул растворителя. Сольваты, содержащие различное число молекул растворителя, находятся в состоянии подвижного равновесия друг с другом.
Различают первичную и вторичную сольватацию. Первичная сольватация — это относительно более прочное связывание ионом непосредственно примыкающих к нему молекул растворителя. Образующиеся при этом сольваты фактически представляют собой комплексы, принимающие участие в броуновском движении как единое целое. Вторичная сольватация обусловлена в основном электростатическим взаимодействием между первично сольвагированным ионом и молекулами растворителя, приводящим к их частичной ориентации в поле иона (рис. 13.3).
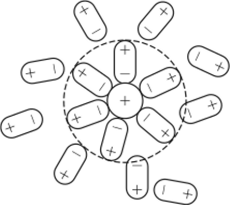
Рис. 13.3. Сольватация катиона в дипольном растворителе. Пунктиром очерчена первичная сольватная оболочка.
Все сказанное, естественно, в полной мере касается водных растворов, на которых мы далее сосредоточим внимание. В этом случае для сольватации используется специальный термин — гидратация. Современные структурно-чувствительные физико-химические методы — рассеяние рентгеновских лучей и нейтронов, а также ядерный магнитный резонанс — подтверждают описанную картину состояния ионов в растворах и уточняют ее. Для большинства исследованных катионов найдено по шесть молекул воды во внутренней координационной сфере, т. е. катионы в растворе можно рассматривать как частицы [М (Н2О)0]. В то же время экспериментальные определения скорости диффузии и подвижности ионов под действием тока показывают, что в растворах с каждым ионом связано гораздо большее число молекул воды. Эти числа, называемые числами гидратации ионов, составляют, например, для Li* в среднем больше 100, а для Cs' 5—10, так что и средний радиус гидратированного иона лития (приблизительно 0,340 нм) больше чем у цезия (0,228 нм), хотя, конечно, радиус иона лития в кристаллах (0,060 нм) гораздо меньше, чем цезия (0,169 нм).
Молекулы воды, находящиеся во внутренней сфере гидратированных ионов, быстро обмениваются с молекулами свободной воды. Среднее время нахождения молекул воды в гидратной оболочке многозарядных ионов при комнатной температуре порядка 10 5 с, а для однозарядных ионов обмен происходит значительно быстрее.
Два иона — протон Н* и гидроксидный анион ОН проявляют аномально высокую подвижность, которая объясняется смещением зарядов по системе водородных связей (рис. 13.4), ответственных за то, что жидкая вода.
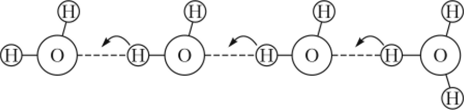
Рис. 13.4. Механизм протонной проводимости в воде.
состоит не из хаотично движущихся независимых молекул, а имеет определенную структуру (см. параграф 18.2). Высокая подвижность ионов Н+ и ОН- лежит в основе очень быстрого протекания реакций, сопряженных с их перемещением, например таких реакций, как нейтрализация кислот и оснований (см. параграф 14.8).