Адсорбция на границе раздела твердое тело — раствор

Для характеристики ионита важно знать его поглощающую способность, которую характеризуют обменной емкостью, измеряемой количеством вещества ионов, поглощенных 1 г сухого ионита из раствора в равновесных условиях. Иониты находят широкое применение в процессах водоподготовки, в пищевой и фармацевтической промышленности, сельском хозяйстве, медицине и г. д. Экспериментально также установлено… Читать ещё >
Адсорбция на границе раздела твердое тело — раствор (реферат, курсовая, диплом, контрольная)
Адсорбция растворенных веществ твердыми адсорбентами является более сложным процессом, чем адсорбция газов твердыми телами, так как она осложнена рядом факторов:
- 1) присутствием третьего компонента — растворителя, молекулы которого могут конкурировать с молекулами адсорбата за места на поверхности адсорбента;
- 2) взаимодействием между молекулами адсорбата и растворителя;
- 3) электростатическим взаимодействием между поверхностью адсорбента и ионами адсорбата, если он является электролитом.
Молекулярная адсорбция. Явление адсорбции из растворов твердыми телами было открыто и изучено в 1785 г. русским химиком и фармацевтом Т. Е. Ловицем (1757—1804).
Неэлектролиты и слабые электролиты на поверхности адсорбента адсорбируются из растворов в виде молекул. Такой процесс называется молекулярной адсорбцией.
В результате адсорбции концентрация растворенного вещества в растворе уменьшается. Величину адсорбции определяют по разности концентраций исходного и равновесного растворов адсорбата.

где с0 — исходная концентрация адсорбата, моль/л; с — равновесная концентрация адсорбата, моль/л; V — объем раствора адсорбата, из которого происходила адсорбция, л; т — масса адсорбента, кг; а — величина адсорбции, моль/кг.
Адсорбция зависит от природы и концентрации адсорбента, температуры, природы адсорбента и растворителя, удельной поверхности адсорбента.
Академик 11. А. Ребиндер (1898—1972) сформулировал следующее правило выравнивания полярностей.
На полярных адсорбентах лучше адсорбируются полярные адсорбаты из малополярных растворителей; на неполярных адсорбентах — неполярные адсорбаты из полярных растворителей.
Для системы адсорбат — адсорбент влияние природы растворителя на адсорбцию может быть также сформулировано в виде следующего правила.
Чем лучше в данном растворителе растворяется данный адсорбат, тем он хуже адсорбируется; чем хуже растворяется — тем лучше из него адсорбируется.
Эти правила можно объяснить тем, что процесс адсорбции из растворов определяется не только энергией взаимодействия между молекулами адсорбата и активными адсорбционными центрами адсорбента, но и энергией взаимодействия между молекулами растворителя и активными адсорбционными центрами.
Как было сказано ранее, адсорбция является экзотермическим процессом. Поэтому с повышением температуры адсорбция уменьшается. Молекулярно-кинетические представления также подтверждают справедливость подобного заключения. Однако в ряде случаев наблюдают обратную зависимость. В узком температурном интервале при достаточно большом температурном коэффициенте растворимости адсорбция с ростом температуры может увеличиваться, если при этом растворимость адсорбата в данном растворителе уменьшается.
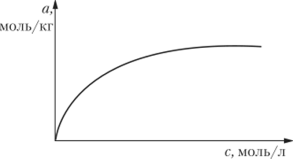
Рис. 23.15. Изотерма адсорбции на границе раздела твердое тело — раствор.
С ростом концентрации раствора адсорбция на границе раздела твердое тело — раствор возрастает до некоторого предельного значения (рис. 23.15). Для математического описания изотермы адсорбции на границе твердое тело — раствор чаще всего используются уравнения Фрейндлиха и Лэнгмюра, анализ которых и методы нахождения числовых значений констант даны в параграфе 173.
При адсорбции ПАВ на границе раздела твердое тело — раствор так же, как и на границе раствор — газ, наблюдается различная ориентация молекул адсорбата. В системе полярный адсорбент — неполярный растворитель молекулы адсорбата обращены полярной частью («головой») к поверхности адсорбента, а неполярная их часть («хвост») погружена в растворитель (рис. 23.16, а). В случае системы полярный адсорбент — полярный растворитель, наоборот, неполярная часть молекулы обращена к поверхности адсорбента, а полярная часть погружена в растворитель (рис. 23.16, 6). В системах полярный растворитель — малополярный адсорбент адсорбция ПАВ подчиняется правилу Дюкло — Траубе.
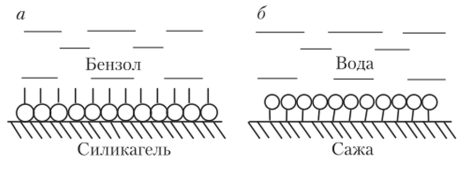
Рис. 23.16. Ориентация молекул ПАВ на границе раздела твердое тело — раствор.
При адсорбции ПАВ из неполярных растворителей полярными адсорбентами выполняется обращенное правило Дюкло — Траубе.
С ростом длины углеводородного радикала адсорбция уменьшается.
Обращение правила объясняется тем, что с ростом длины углеводородной цепочки растет растворимость ПАВ в неполярных растворителях.
Адсорбция сильных электролитов. В растворах сильных электролитов растворенное вещество находится в полностью ионизированном состоянии. Поэтому их адсорбция обладает рядом характерных особенностей. Ионы адсорбируются лишь на полярных и практически не адсорбируются на неполярных адсорбентах.
Основными факторами, обусловливающими специфичность адсорбции сильных электролитов, являются знак заряда поверхности адсорбента, величина и знак заряда иона, его радиус и степень сольватации. На положительно заряженных участках поверхности адсорбента адсорбируются из раствора анионы, на отрицательно заряженных — катионы.
Пример 23.2. Чистый уголь является неполярным адсорбентом, на котором электролиты практически не адсорбируются. Поверхность угля, окисленного в нагретом состоянии кислородом, приобретает полярные группы. В воде и водных растворах такая поверхность заряжается положительно и хорошо адсорбирует анионы: 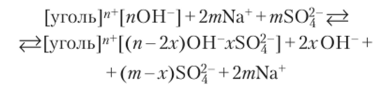
Поверхность угля, обработанного в нагретом состоянии в атмосфере водорода, в воде и водных растворах заряжается отрицательно и хорошо адсорбирует катионы:
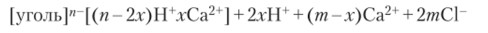
Адсорбционная способность ионов (особенно катионов) на данной поверхности возрастает с увеличением их заряда.
Экспериментально также установлено правило, что при одинаковых зарядах адсорбционная способность больше у тех ионов, радиус которых в сольватированном состоянии меньше. В соответствии с этим правилом ионы по их адсорбционной способности располагаются в определенной последовательности, получившей название лиотропных рядов.
Лиотропный ряд адсорбции катионов в воде имеет следующий вид:

Различают три вида адсорбции сильных электролитов: эквивалентную, избирательную и ионнообменную.
Эквивалентная адсорбция встречается редко и характеризуется тем, что и катионы, и анионы адсорбируются на поверхности адсорбента в эквивалентных количествах.
Избирательная адсорбция подчиняется правилу, установленному американским физико-химиком К. Фаянсом (1887—1975).
На поверхности данного адсорбента преимущественно адсорбируются те ионы, которые могут достраивать кристаллическую решетку этого адсорбента.
Иллюстрацией правила Фаянса может служить зарядка поверхности кристаллического осадка иодида серебра, полученного по реакции.
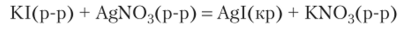
В случае эквивалентных количеств KI и AgN03 поверхность осадка не заряжена (рис. 23.17, а). При избытке AgN03 поверхность осадка заряжена положительно (рис. 23.17, б), а при избытке KI — отрицательно (рис. 23.17, в).

Рис. 23.17. Возникновение заряда на поверхности адсорбента (кристаллов Agl) вследствие избирательной адсорбции:
а — c (AgN ()3) = с (KI); б — с (AgNC)3) > с (KI); в — с (AgNC)3) < с (К!).
Переход ионов из объемной фазы в поверхностный слой приводит к возникновению двойного электрического слоя, подобного конденсатору с двумя заряженными обкладками.
Ионообменная адсорбция — широко распространенный вид адсорбции сильных электролитов.
Ионообменной адсорбцией называют процесс, в котором адсорбент и раствор обмениваются между собой в эквивалентных количествах одноименно заряженными ионами: 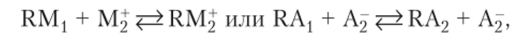
где RM1? RAj — адсорбенты, содержащие катионы М{ или анионы At и способные к обмену соответственно с катионом М2 и анионом А2 в растворе. Они получили название ионитов. Это твердые природные или синтетические вещества, практически нерастворимые в воде и органических растворителях.
Иониты обладают сетчатой структурой (каркас, матрица) (рис. 23.18). В сетке закреплены группы атомов R+(R), несущих положительный или отрицательный заряд (фиксированные ионы). Этот заряд компенсируется так называемыми противоионами (М+ или А-). Фиксированные ионы вместе с подвижными противоионами (R_M+ или R+A) называют ионогенными или функциональными группировками ионита.
По типу ионогенных групп иониты делят на катиониты R~M+ (кислотные иониты, обменивающие катион) и аниониты R+A~ (основные иониты, обменивающие анион).
Ионит, помещенный в воду или водный раствор, поглощает значительное количество воды (иногда до 50%), увеличиваясь при этом в объеме. Поглощенная вода гидратирует ионогенные группы и вызывает их ионизацию. По степени ионизации ионогенных групп иониты делят на сильнои слабокислотные катиониты и сильнои слабоосновные аниониты.
Сильнокислотные катиониты в качестве ионогенных групп содержат остатки серной, фосфорной и других кислот, а слабокислотные — карбоксильные, сульфгидрильные и другие группы. Ионогенные группы сильноосновных анионитов представляют собой обычно группы аммониевых или сульфопиевых оснований, а слабооснбвных — аминогруппы различной степени замещения, пиридиновые основания.
Зерно катионита (см. рис. 23.18, а) можно рассматривать как гигантский поливалентный анион, отделенный физической поверхностью раздела от окружающей среды. Внутренняя часть такого поливалентного аниона пропитана раствором, содержащим большое число ионов водорода (или других катионов), способных обмениваться на катионы, находящиеся в жидкости, окружающей зерно катионита.
Зерно анионита (см. рис. 23.18, б) можно рассматривать как гигантский поливалентный катион, противоионами которого являются гидроксидионы (или другие анионы), способные обмениваться на анионы.
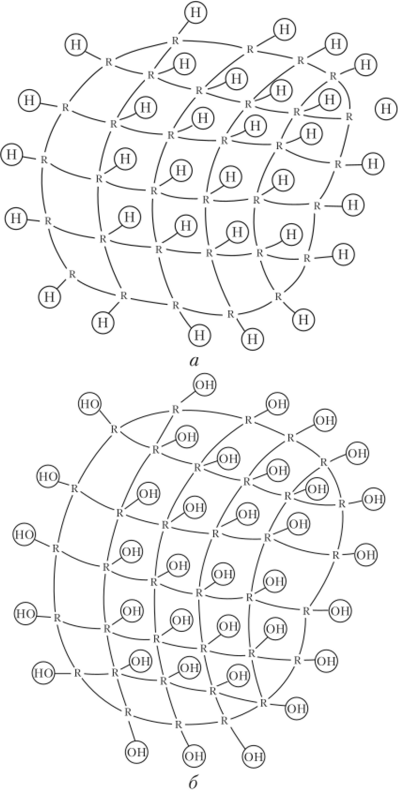
Рис. 23.18. Строение зерна:
а — катионита, 6 — анионита
Ионообменные реакции с участием ионитов можно представить следующими уравнениями (R — матрица ионита): 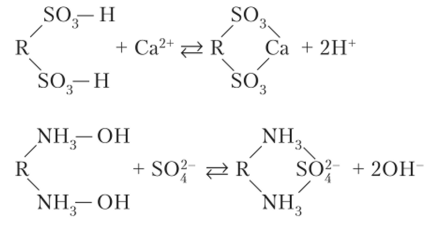
Ионный обмен — обратимый процесс, что дает возможность регенерировать использованные иониты. Регенерацию производят пропусканием через слой катионита какой-либо кислоты или пропусканием раствора щелочи через слой анионита.
Для характеристики ионита важно знать его поглощающую способность, которую характеризуют обменной емкостью, измеряемой количеством вещества ионов, поглощенных 1 г сухого ионита из раствора в равновесных условиях. Иониты находят широкое применение в процессах водоподготовки, в пищевой и фармацевтической промышленности, сельском хозяйстве, медицине и г. д.