Реакция почвенного раствора
Различают два вида почвенной кислотности — активную (актуальную) и потенциальную. Активная кислотность обусловлена ионами Н+ или А1+3, находящимися в почвенном растворе. Измеряют ее потенциометрически после достаточно долгого (в течение нескольких часов) взаимодействия почва — вода (в отношении 1: 2,5). Обозначают символом рНн2о. В многолетней практике лабораторных исследований почв приняты… Читать ещё >
Реакция почвенного раствора (реферат, курсовая, диплом, контрольная)
Реакция почвенного раствора (pH) определяется активностью свободных Н+ и ОН' и измеряется величиной его pH — отрицательным логарифмом активности Н±ионов.
![Кислотность почв определяется величиной концентрации ионов водорода в почвенном растворе. Вода в слабой степени подвергается электролитической диссоциации, распадается на два иона: Н+ и ОН'. Концентрация этих ионов очень мала: произведение концентраций —> | Н+| х [ОН] = 10'14.](/img/s/8/11/1453711_1.png)
Кислотность почв определяется величиной концентрации ионов водорода в почвенном растворе. Вода в слабой степени подвергается электролитической диссоциации, распадается на два иона: Н+ и ОН'. Концентрация этих ионов очень мала: произведение концентраций —> | Н+| х [ОН] = 10'14
Так как количество диссоциированных ионов [Н+] и [ОН ] для воды одинаково, то 10'14 = [Н+]2. Поэтому, [Н+] = V 10'14 = 10 7. В абсолютно чистой воде должно находиться равное количество [Н+] = [ОН]=Ю'7. Кислоты, присутствующие в почвенном растворе, повышают концентрацию Н+— ионов (Н+ > 10) и создают кислую реакцию. Присутствие оснований или щелочей повышают концентрацию ОН — ионов и создают щелочную реакцию (Н+ < 10'7). Поскольку иметь дело с такими малыми показателями неудобно, оперируют с отрицательным десятичным логарифмом величин концентрации Н+-иона. Этот логарифм обозначается символом pH. Следовательно, pH = — lg[H+|.
В нейтральных растворах величина pH = 7, в щелочных — pH > 7, в кислых — pH < 7. Величина pH почвенного раствора изменяется от 3 до 9.
Различают два вида почвенной кислотности — активную (актуальную) и потенциальную. Активная кислотность обусловлена ионами Н+ или А1+3, находящимися в почвенном растворе. Измеряют ее потенциометрически после достаточно долгого (в течение нескольких часов) взаимодействия почва — вода (в отношении 1: 2,5). Обозначают символом рНн2о.
Потенциальная кислотность обусловлена обменными катионами Н+ или А1+3 и проявляется при взаимодействии почв с растворами солей. Потенциальную кислотность делят на обменную и гидролитическую. Кислотность почв гидролитическая обусловлена ионами Н+, удерживаемыми почвенными коллоидами и способными замещаться металлами при титровании почвы основанием. Она зависит в основном от способности коллоидов фиксировать ионы Н. Выражается в мг-экв/100 г сухой почвы.
Кислотность почв обменная — при обработке почвы солью сильной кислоты, например, КС1, происходит обмен между ионами К+ раствора и ионами Н+, связанными почвенным поглощающим комплексом. Обозначают символом pH. Обменная кислотность почв обычно ниже актуальной.
Кислотность почв потенциальная проявляется при взаимодействии почвы с нейтральными или гидролитически щелочными солями; включает кислотность обменную и гидролитическую.
В многолетней практике лабораторных исследований почв приняты следующие значения pH для определения степени кислотности или щелочности почвы: 3,0—4,5 — сильнокислые; 4,6—5,0 — кислые; 5,1—5,5 — слабокислые; 5,6—6,0 — близкие к нейтральным; 6,1—7,0 — нейтральные; 7,1 — 7,5 — слабощелочные; 7,6—8,5 — щелочные; 8,6 и выше — сильнощелочные.
Почвенная реакция имеет важное значение для развития микробиологических процессов и роста растений. Многие микроорганизмы наиболее хорошо развиваются при реакции почвенного раствора, близкой к нейтральной. В почвах с нейтральной и слабощелочной реакцией преобладают бактерии, а в почвах с кислой реакцией — грибы. Оптимальные интервалы pH для некоторых групп почвенных микроорганизмов приведены в табл. 6.13.
Таблица 6.13
Отношение микроорганизмов к реакции почвы (но Е. Н. Мишустину, 1975)
Микроорганизмы. | Значение pH, в пределах которых возможно развитие микроорганизмов. | ||
минимальное. | оптимальное. | максимальное. | |
Гнилостные бактерии. | 4,5. | 7,0. | 9,0. |
Клубеньковые бактерии. | 4,3. | 7,0. | 10,0. |
Азотобактер | 5,0. | 7,0. | 9,0. |
Нитрификаторы. | 4,0. |
о. | 10,0. |
Микроорганизмы. | Значение pH, в пределах которых возможно развитие микроорганизмов. | ||
минимальное. | оптимальное. | максимальное. | |
Акциномицегы. | 4,5. | 7,0. | 9,0. |
Плесени. | 3,5. | 7,0. | 9,0. |
Для развития большинства культурных растений наиболее благоприятны почвы с нейтральной реакцией.
Реакцию почвенного раствора можно изменить в благоприятную сторону, внося различные минеральные вещества:
- а) для уменьшения кислотности почв вносят известь;
- б) для уменьшения щелочности проводят гипсование, кислотование, вносят физиологически кислые удобрения (суперфосфат, сернокислый аммоний, нитрат аммония);
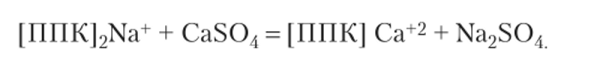
Образовавшийся в результате этой реакции сернокислый натрий водорастворим и легко вымывается из почвы, а внесенный с гипсом кальций улучшает ее свойства.
Щелочность почвы — содержание в почве соединений (главным образом карбонатов натрия или магния и гуматов натрия), обусловливающих ее щелочность. Показатель щелочности почв pH — почвенного раствора выше 8,3. Различают актуальную и потенциальную щелочность.
Актуальная щелочность определяется содержанием в почвенном растворе преимущественно карбонатов и гидрокарбонатов щелочных и щелочноземельных металлов (Na2C03, NaHC03, Са (НС03)2).
Потенциальная щелочность почв определяется содержанием обменного натрия, который может переходить в почвенный раствор, подщелачивая его.
В табл. 6.14 представлено распределение почв, но уровню кислотности и щелочности.
Таблица 6.14
Уровни кислотности и щелочности почв.
pH. | Уровень кислотности или щелочности почв. | Почвы. |
<4,5. | Сильнокислая. | Болотные, болотно-подзолистые, подзолистые, красноземы. |
4,6−5,0. | Кислая. | Подзолистые, дерново-подзолистые, красноземы. |
5,1−5,5. | Слабокислая. | То же. |
5,6−6,0. | Близкая к нейтральной. | Окультуренные дерново-подзолистые, красноземы, серые лесные. |
6,1−7,1. | Нейтральная. | Серые лесные, черноземы. |
pH. | Уровень кислотности или щелочности почв. | Почвы. |
7,2−7,5. | Слабощелочная. | Черноземы, каштановые, сероземы. |
7,6- 8,5. | Щелочная. | Солонцы, солончаки. |
>8,5. | Сильнощелочная. | То же. |
Буферность почв — способность почвы противостоять изменению концентрации почвенного раствора под воздействием различных факторов.
Большинство живых организмов может существовать при pH от 2,5—3,0 до 9—10,5. За пределами этих концентраций ионов водорода организмы встречаются крайне редко. В процессе эволюции многие растения выработали адаптацию к кислотно-щелочным условиям в почве.
Сформировалось три группы растений по отношению к кислотности почвы: ацидофилы — растения кислых почв, нейтрофилы — обитатели нейтральных почв, базифилы — растения щелочных почв. Зная растения каждой группы, в полевых условиях можно приблизительно определить кислотность почвы. В табл. 6.15 представлены растения, которые приспособились к тем или иным кислотно-щелочным условиям.
Таблица 6.15
Растения — индикаторы кислотности почв.
Группа. | Биоиндикатор | pH почвы. |
Ацидофилы. | ||
Крайние ацидофилы. | Сфагнум, зеленые мхи: гилокомиум дикранум; плаун булавовидный, плаун годичный, плаун сплюснутый, ожика волосистая, пушица влагалищная, подбел многолистный, кошачьи лапки, белоус, щучка дернистая. | 1П чГ. I. О го. |
Умеренные ацидофилы. | Черника, брусника, багульник, калужница болотная, лютик ядовитый, толокнянка, седмичник европейский, белозор болотный, фиалка собачья, сердечник луговой, вейник наземный. | 4,5−6,0. |
Слабые ацидофилы. | Папоротник мужской, ветреница лютиковая, медуница неясная, зеленчук, колокольчик широколистный, бор развесистый, осока волосистая, осока ранняя, малина, смородина черная, вероника длиннолистная, горец змеиный, орляк, иван-да-марья, кисличка заячья. | 5,0—6,7. |
Ацидофильнонейтральные. | Зеленые мхи: гилокомиум, плеврозиум; ива козья. | 4,5−7,0. |
Нейтрофильные. | ||
Околоней; тральные. | Сныть европейская, клубника зеленая, лисохвост луговой, клевер горный, клевер луговой, мыльнянка лекарственная, аистник цикутный, борщевик сибирский, цикорий, мятлик луговой. | 6,0−7,3. |
Группа. | Биоиндикатор | pH почвы. |
Нейтрально; базифильиые. | Мать-и-мачеха, пупавка красильная, люцерна серповидная, келерия, осока мохнатая, лядвеиец рогатый, гусиная лапка. | 6,7−7,8. |
Базифильные. | ||
Базифильные. | Бузина сибирская, вяз шершавый, бересклет бородавчатый. |
О |
Для большинства культурных растений оптимальными являются нейтральная и близкая к нейтральной реакция почвенного раствора — pH 6—7. Только для незначительного числа культурных растений (чайный куст, картофель, люпин и др.) оптимальной является кислая среда — pH 4.5—6,0.
Повышенная кислотность оказывает негативное влияние на развитие растений, так как проявляется в недостаточном содержании катионов кальция, гния, молибдена и других элементов и токсичности катионов водорода, алюминия. Это ведет к нарушению питания растений фосфором, азотом, подавлению деятельности полезной микрофлоры, угнетению процессов аммонификации и нитрофикации.
Повышенная щелочность снижает плодородие почвы еще в большей степени. Почвы со щелочной реакцией имеют неудовлетворительные водно-физические свойства из-за пептизации коллоидов (солонцы, солонцеватые почвы).
Для устранения избыточной кислотности и щелочности почв приводят химические мелиоративные приемы — известкование кислых почв, гипсование и кислование щелочных почв.
Окислительно-восстановительный потенциал почв. В почве широко развиты окислительно-восстановительные процессы. При окислении происходит потеря электрона окисляющим элементом, при восстановлении — присоединение электрона восстанавливающимся элементом. Реакцию окисления — восстановления, можно представить в виде.
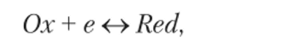
где Ох — окислитель, Red — восстановитель, е — электрон.
Реакции окисления всегда сопровождаются реакциями восстановления и протекают сопряженно. Поэтому говорят об окислительно-восстановительных реакциях, или процессах.
Главным окислителем в почвах является кислород почвенного воздуха и растворенный в почвенной влаге, а восстановителями выступают органическое вещество, водород и сероводород.
Для характеристики окислительно-восстановительных условий определяют окислительно-восстановительный потенциал (Eh).
Окислительно-восстановительный потенциал почвы — разность потенциалов, возникающая между почвенным раствором и электродом из инертного металла (платина). Измеряется при помощи потенциометра.
Большой вклад в изучение окислительно-восстановительных процессов в почве внесли работы С. П. Яркова, И. П. Сердобольского, И. С. Кауричева, Д. С. Орлова, В. И. Савича и других.
Уровень окислительно-восстановительного потенциала (Eh) отражает преобладание процессов окисления или восстановления, выражается в милливольтах (мВ). Окислительно-восстановительные процессы связаны с реакцией среды, величиной pH. В щелочной среде окисление идет при более низких значениях Eh, чем в кислых.
Главные условия, которые определяют интенсивность и направленность окислительно-восстановительных процессов — увлажнение и аэрация почв, содержание органических веществ и деятельность микрофлоры.
Значение Eh колеблется от 600—700 мВ в почвах с хорошей аэрацией и окислительным режимом до 150—200 мВ в переувлажненных почвах и восстановительным режимом. В резковосстановительной сероводородной обстановке Eh равен нулю и приобретает отрицательные значения.
Для автоморфных почв характерны высокие уровни Eh — 550—750 в подзолистых почвах, 400—600 в черноземах, 350—450 в сероземах.
Окислительно-восстановительный потенциал почв неоднороден в пределах почвенного профиля и динамичен во времени.
По характеру протекающих окислительно-восстановительных процессов А. И. Перельман (рис. 6.9) выделил три ряда почв:
- 1) почвы с преобладанием окислительной среды;
- 2) почвы с восстановительной глеевой обстановкой;
- 3) почвы с резковосстановительной сероводородной средой.

Рис. 6.9. А. И. Перельман (1916—1998) — советский ученый, почвовед и геохимик, доктор геолого-минералогических наук (1954), профессор (1967), академик РАЕН (1991). Главная тема научной деятельности — геохимия ландшафта, основы которой изложены в книгах «Геохимия ландшафта», издаваемых в 1961, 1966, 1975, 1999 гг. Одно из важнейших научных достижений Александра Ильича — учение о геохимических
барьерах И. С. Кауричевым и Д. С. Орловым предложена более детальная группировка почв в соответствии с окислительно-восстановительными условиями.
- 1. Почвы с абсолютным господством окислительной обстановки — автоморфиые почвы степей, полупустынь и пустынь.
- 2. Почвы с господством окислительной обстановки при возможном проявлении восстановительных процессов в отдельные влажные годы или сезоны — автоморфные почвы таежно-лесной зоны, влажных субтропиков и широколиственных лесов.
- 3. Почвы с контрастным окислительно-восстановительным режимом (полугидроморфные почвы различных зон):
- 1) с развитием сезонных восстановительных процессов в верхних горизонтах;
- 2) развитием оглеения в нижних горизонтах;
- 3) контрастной сменой восстановительной и окислительной обстановок по всему профилю.
- 4. Почвы с господством восстановительных условий по всему профилю:
- 1) с господством глеевой обстановки;
- 2) с господством сероводородной обстановки.
Окислительно-восстановительные процессы контролируют фазовые переходы в почвах. Многие химические соединения элементов с переменной валентностью при смене окислительно-восстановительных условий многократно переходят из твердой фазы в жидкую, из жидкой — в газообразную, и наоборот. Эти фазовые переходы веществ имеет определенным ритм — суточный, сезонный и многолетний.
Значение окислительно-восстановительного потенциала позволяет судить об общей направленности окислительно-восстановительных процессов и определить необходимые мероприятия по регулированию окислительно-восстановительного режима с целью повышения плодородия почв.