Реакции обнаружения катионов второй аналитической группы

Для полного осаждения бария к раствору помимо бихромата калия для нейтрализации выделяющейся кислоты добавляют избыток ацетата натрия, с которым продукты реакции образуют ацетатную буферную смесь, обеспечивающую оптимальное значение pH раствора (pH 5). Эта реакция служит как для открытия, так и для отделения катиона бария от кальция и стронция. Предельное разбавление для нее 1:12 500. Описание… Читать ещё >
Реакции обнаружения катионов второй аналитической группы (реферат, курсовая, диплом, контрольная)
Ко 2-й группе относятся ионы Са2+, Sr+ и Ва2+. Образующие их металлы расположены во 2-й группе периодической системы, называются щелочноземельными и характеризуются высокой химической активностью.
Ионы Са2+, Sr+ и Ва2~ (в отличие от катионов 1-й группы) образуют малорастворимые в воде карбонаты. Поэтому их осаждают действием карбоната аммония (NH4)2C03, который и является групповым реагентом.
Из солей Са2+, Sr2' и Ва2" нерастворимы, кроме того, сульфаты, фосфаты и оксалаты.
От катионов 3—5-й групп Са2+, Sr2+ и Ва2" отличаются хорошей растворимостью сульфидов в воде.
Групповой реагент — (NH^CC^ гидролизуется по реакции или 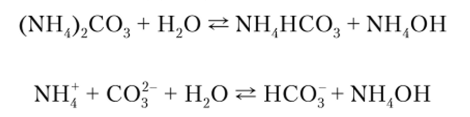
Гидролиз препятствует полному осаждению катионов 2-й группы, так как кислые соли Са (НС03)2, Sr (HC03)7 и Ва (НС03)2 растворимы в воде. Для подавления гидролиза карбоната аммония к раствору прибавляют NH4OH. Нагревание раствора до 50—70°С предотвращает частичное разложение карбоната аммония до карбамината аммония (NH2COONH4), не осаждающего катионы 2-й группы. Кроме того, нагревание способствует превращению аморфного осадка в кристаллический, легче отделяемый центрифугированием.
При действии карбоната аммония помимо катионов 2-й группы частично осаждается ион Mg2+ в виде основной соли:
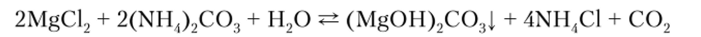
При добавлении хлорида аммония этот осадок растворяется.
Итак, катионы 2-й группы осаждают карбонатом аммония (МН4)2С03 в присутствии NH4OH и ЫН4С1 при нагревании раствора до 50—70°С.
Барий
А) Реакция с бихроматом (дихроматом) калия
Бихромат калия К2Сг207 выделяет из растворов солей бария желтый осадок хромата бария ВаСг ()4, так как последний менее растворим, чем бихромат бария: 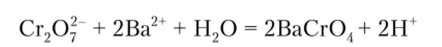
Для полного осаждения бария к раствору помимо бихромата калия для нейтрализации выделяющейся кислоты добавляют избыток ацетата натрия, с которым продукты реакции образуют ацетатную буферную смесь, обеспечивающую оптимальное значение pH раствора (pH 5). Эта реакция служит как для открытия, так и для отделения катиона бария от кальция и стронция. Предельное разбавление для нее 1:12 500.
Описание опыта. К 2—3 каплям раствора соли бария приливают 1—2 капли раствора ацетата натрия и 2—3 капли раствора бихромата калия. Следует испытать растворимость осадка в соляной и уксусной кислотах.
Б) Реакция с серной кислотой и растворимыми сульфатами
Серная кислота или растворимые сульфаты образуют с катионом бария белый мелкокристаллический осадок:
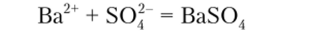
Описание опыта. К 2—3 каплям раствора соли бария прибавляют столько же серной кислоты или раствора сульфата натрия Na2S04 и убеждаются, что сульфат бария нерастворим в кислотах. Гипсовая вода (насыщенный раствор гипса CaS04 • 2Н20) даст с растворами солей бария белую муть, появляющуюся сразу же после начала реакции.
Стронций
А) Реакция с растворимыми сульфатами и гипсовой водой
Серная кислота и растворимые сульфаты дают с ионом стронция нерастворимый в кислотах белый осадок сульфата стронция:
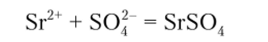
При действии гипсовой воды образуется небольшая белая муть, появляющаяся не сразу (отличие от бария!) из-за образования пересыщенного раствора (убедитесь в этом на соответствующем опыте). В ходе анализа эта реакция служит для открытия стронция, но только после отделения бария.
Б) Обнаружение родизонатом натрия
Описание опыта. На фильтровальную бумагу помещают каплю нейтрального раствора соли стронция и действуют каплей водного раствора родизоната натрия Na2C606. При этом на бумаге появляется красно-бурое пятно осадка SrC606. При смачивании пятна каплей разбавленной соляной кислоты осадок растворяется и пятно исчезает.
Катион бария с родизонатом образует такой же осадок родизоната бария, который, однако, легко отличить от родизоната стронция, так как при действии соляной кислоты он становится розово-красным.
Реакция очень удобна для дробного обнаружения стронция и бария в присутствии всех остальных катионов 1-й и 2-й аналитических групп. Катионы других групп должны отсутствовать.
Кальций
А) Реакция с растворимыми сульфатами
Ион S04 осаждает кальций только из достаточно концентрированных растворов его солей. Осадок растворяется в сульфате аммония с образованием комплексной соли (NH4)2| Ca (S04)2]. Растворы солей кальция в отличие от бария и стронция не образуют мути с гипсовой водой.
Б) Реакция с гексацианоферратом (П) калия
Гексацианоферрат (П) калия K4|Fe (CN)G] из растворов солей кальция в присутствии аммонийной буферной смеси выделяет белый кристаллический осадок, нерастворимый в уксусной кислоте:
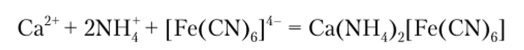
Ион стронция не мешает обнаружению кальция, но барий образует аналогичный осадок и, следовательно, перед обнаружением кальция должен быть удален.
Описание опыта. К 1—2 каплям раствора соли кальция прибавляют по капле растворов NH4OH и NH4C1, нагревают и осаждают кальций действием 3—4 капель насыщенного раствора KJFe (CN)6].
В) Реакция с оксалатом аммония
Оксалат аммония (NH4)2C204 осаждает из растворов солей кальция белый мелкокристаллический осадок оксалата кальция:
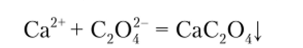
Описание опыта. К 1—2 каплям раствора соли кальция прибавляют столько же оксалата аммония. Нагревание способствует быстрому осаждению осадка, который растворим в минеральных кислотах, но нерастворим в уксусной кислоте. Этой реакцией обнаруживают кальций, но только после удаления бария и стронция, которые также образуют аналогичные осадки.
Результаты действия важнейших реагентов на катионы второй группы приведены в табл. 3.4. Как очевидно из таблицы, карбонаты, фосфаты, оксалаты и сульфаты катионов 2-й группы малорастворимы в воде. Растворимость сульфатов повышается в ряду Ва, Sr, Са. Из хроматов нерастворимы лишь ВаСЮ4 и SrCr04. Хромат кальция растворим хорошо.
Таблица 3.4
Реакции катионов 2-й группы.
Реагенты. | Катионы. | ||
Ва2*. | Sr2+ | Са2+ | |
(NH4)2CO, +. + NHjOH + NH4CI. | Белый осадок ВаС03 | Белый осадок SrC03 | Белый осадок СаС03 |
Na2HP04 | Белый осадок ВаНР04 | Белый осадок SrHP04 | Белый осадок СаНР04 |
H2S04 и растворимые сульфаты. | Белый осадок BaS04 | Белый осадок SrS04 | Белый осадок* CaS04 |
CaS04 | Белый осадок BaS04 выпадает сразу. | Белый осадок SrS04 выпадает не сразу. | —. |
(NH4)C204 | Белый осадок ВаС204 | Белый осадок SrC204 | Белый осадок СаС204 |
K2CrO,. | Желтый осадок ВаСЮ4 | Желтый осадок SrCr04 | —. |
K2Cr, 07 +. + CH3COONa. | Желтый осадок ВаСг04 | —. | —. |
K"[Fe (CN)6] +. + NH4OH + NH4C1. | **. | —. | Белый осадок Ca (NH4)2[Fe (CN)G]. |
Окрашивание пламени. | Желто-зеленое. | Карминово-красное. | Кирпично-красное. |
* Осадок выпадает только из концентрированных растворов.
** При большой концентрации Ва2* возможно образование осадка.