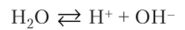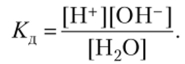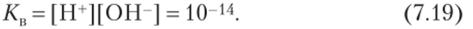Вода является очень слабым электролитом. Процесс диссоциации ее можно описать константой равновесия: 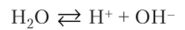
Но так как концентрация воды в процессе диссоциации практически не меняется, ее можно включить в константу, тогда получается выражение Ки, которое называется ионным произведением воды и равно 1(Н4:
Таким образом, в водных растворах концентрации ионов водорода и гидроксил-ионов связаны между собой, и зная величину концентрации одного иона, можно легко определить концентрацию второго иона.
Водородный показатель. Вода является амфотерным веществом, так как при диссоциации распадается на ионы водорода и гидроксила. В присутствии других веществ соотношение ионов может меняться. Для характеристики кислотности среды датским ученым С. П. Л. Сёренсеном в 1909 г. введен водородный показатель, или рн — это отрицательный логарифм концентрации ионов водорода в растворе:
Зная величину pH, можно вычислить концентрацию ионов водорода в растворе:
В чистой воде концентрация ионов водорода и гидроксид-ионов равны 10-7 моль/л. Логарифм этой величины, взятый с обратным знаком, равен 7. При pH = 7 — среда нейтральная. В кислой среде концентрация ионов водорода будет больше, соответственно pH будет меньше 7 (при pH < 7 — среда кислая). В щелочной среде — при больше 7.
Приближенно величину pH можно определить, используя кислотно-основные индикаторы. Кислотно-основными индикаторами, или просто индикаторами, называют вещества, меняющие свою окраску в определенной области значений pH раствора. Индикаторами могут быть слабые органические кислоты Hind и основания IndOH, молекулы и ионы которых имеют разную окраску.
Существует так называемый универсальный индикатор — это смесь различных индикаторов. Цвет его изменяется от красной (pH 8,5).
Гораздо точнее можно измерить значения pH специальными приборами — pH-метрами (рис. 7.4). При помощи этих приборов можно определить pH растворов в диапазоне от 0 до 14 с точностью до 0,01 единицы pH.

Рис. 7.4. рН-метр-ионометр ЭКСПЕРТ-001:
- 1 — внешний вид измерительного преобразователя;
- 2 — цифровой ЖК-дисплей; 3 — клавиатура; 4 — температурный датчик;
- 5 — электрод стеклянный комбинированный (для измерения pH);
- 6 — пробка для отверстия