Биохимия азотфиксации.
Микробиология

Фиксация азота атмосферы представляет собой восстановительный процесс, и первым его продуктом, который можно выявить, служит аммиак. Процесс восстановления азота представляет собой ряд ферментативных реакций, осуществляемых ферментным комплексом нитрогеназой. Активный центр нитрогеназы содержит два компонента: первый состоит из белка, в состав которого входят молибден, железо и сера, или… Читать ещё >
Биохимия азотфиксации. Микробиология (реферат, курсовая, диплом, контрольная)
Молекула азота характеризуется очень прочной тройной связью, которая обусловливает инертные свойства газа. Так, азот с трудом вступает в химическую связь с другими элементами и веществами. Используемый в производстве азотных минеральных удобрений метод ГабераБоша, заключающийся в синтезе аммиака из молекулярного азота и водорода на катализаторах, требует высоких температуры и давления. В то же время микробиологическое связывание молекулярного азота осуществляется при обычных температуре и давлении.
Фиксация азота атмосферы представляет собой восстановительный процесс, и первым его продуктом, который можно выявить, служит аммиак. Процесс восстановления азота представляет собой ряд ферментативных реакций, осуществляемых ферментным комплексом нитрогеназой. Активный центр нитрогеназы содержит два компонента: первый состоит из белка, в состав которого входят молибден, железо и сера, или Mo-Fe-белка, второй — из белка, содержащего железо и серу, или Fe-S-белка. Выявлена также ванадийсодержащая нитрогеназа, однако уровень активности ее на 30% ниже, чем у модибденсодержащей нитрогеназы. В природных субстратах при нехватке молибдена последний может замещаться ванадием.
Впервые нитрогеназа была обнаружена в клетках анаэробного азотфиксатора Clostridium pasteurianum, затем у аэробных свободноживущих бактерий, клубеньковых бактерий и других связывающих азот микроорганизмов. Нитрогеназа и катализуемый ею процесс фиксации азота характеризуются чрезвычайно высокой чувствительностью к молекулярному кислороду. Последний служит энергичным акцептором водорода и подавляет образование восстановленных продуктов азота.
У свободноживущих азотфиксаторов существуют особые механизмы, защищающие нитрогеназу от кислорода. Как уже отмечалось, у клубеньковых бактерий функцию защиты нитрогеназы от высокого парциального давления кислорода выполняет леггемоглобин, обладающий высоким сродством к кислороду. Леггемоглобин цитоплазмы клеток клубенька, в которых локализованы бактероиды, препятствует свободному доступу кислорода, обеспечивая дозированное его поступление, что необходимо бактероидам для роста и получения энергии, и в то же время не сказывается отрицательно на фиксации азота.
Считают, что процесс связывания молекулярного азота начинается с поступления азота, растворенного в воде, в азотфиксирующий центр, где в активации молекулы азота участвуют два атома молибдена (рис. 51). В результате взаимодействия с азотом молибден восстанавливается, принимая электроны, которые поступают в активный центр через Fe-S-белок и Mo-Fe-белок. Такой перенос электронов связан с гидролизом АТФ, т. е. идет с затратой энергии. В транспорте электронов к нитрогеназе принимает участие железосодержащий водорастворимый белок-фермент феррсдоксин, а в активации водорода воды и переносе протонов — фермент гидрогеназа.

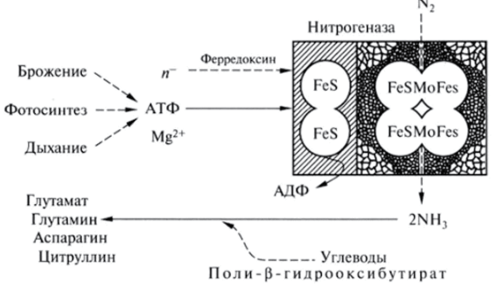
Рис. 51. Схема взаимосвязи процессов, лежащих в основе фиксации молекулярного азота (по: В. Л. Крстович).
Восстановленный ферредоксин, служащий донором электронов, образуется у свободноживущих азотфиксаторов рода Clostridium при так называемом фосфорокластическом расщеплении пирувата с образованием, а цетил фосфата, а у пурпурных зеленых серобактерий и цианобактерий — в процессе фотосинтеза.
Главный источник АТФ у аэробных азотфиксаторов — окислительное фосфорилирование, у анаэробных — фосфорокластическая реакция, у фототрофных фиксаторов азота — фотофосфорилирование. Для клубеньковых бактерий источником энергии для процесса фиксации азота служат продукты фотосинтеза, поступающие из листьев растений. Они трансформируются и запасаются в бактероидах главным образом в виде пол и-(5-гид роке и масля ной кислоты, при использовании которой происходит образование АТФ.
Восстановление одной молекулы азота до двух молекул NH3 требует затраты энергии в виде 12 молекул АТФ:
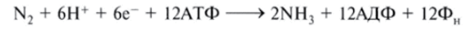
Как видно, процесс фиксации молекулярного азота связан с затратами большого количества энергии. Например, Clostridium pasteurianum для связывания 1 мг N2 в процессе брожения перерабатывает 500 мг сахара. Источниками протонов, электронов и АТФ служат процессы брожения (у анаэробных азотфиксаторов), дыхания (у аэробных азотфиксаторов) и фотосинтеза (у цианобактерий, пурпурных и зеленых серных бактерий).
Восстановление молекулярного азота до аммиака осуществляется в т р и последовательные стадии. Вначале N2 превращается вдиимид (HN=NH), затем в гидразин (H2N—NH2)h, наконец, в NH3:
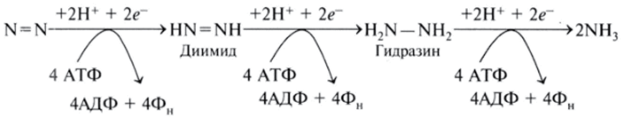
Установлено, что нитрогеназа может восстанавливать не только молекулярный азот (N=N), но и ацетилен (НС=СН), азид, закись азота, цианид, нитриты, изонитрилы и протоны. На восстановлении ацетилена основан метод, который используют для выявления нитрогеназы. Ацетилен восстанавливается только до этилена, который достаточно легко определить методом газовой хроматографии. Все до настоящего времени изученные азотфиксирующие бактерии и симбиотические ассоциации обладают способностью восстанавливать ацетилен в этилен. Нитрогеназная система при участии АТФ катализует также восстановление протонов, сопряженно образующихся в процессе азотфиксации, до молекулярного водорода.
Аммиак, образовавшийся в процессе фиксации N2, связывается кетокислотами, что приводит к синтезу аминокислот. Так, из.
2-оксоглутарата и аммиака получается глутаминовая кислота. Глутаминовая кислота с затратой энергии в виде АТФ превращается в глутамин, а из него синтезируется важнейший метаболит — аспарагин. Из щавелевоуксусной кислоты и аммиака образуется аспарагиновая кислота, из пирувата и NH3 — а-аланин и т. д. В дальнейшем аминокислоты идут на синтез белков и других азотсодержащих органических соединений.
Процесс связывания молекулярного N2 бактериями подвержен регуляции. Так, у многих микроорганизмов синтез нитрогеназы происходит только тогда, когда она нужна, т. е. когда в среде отсутствует источник связанного азота. В присутствии ионов аммония синтез фермента подавляется. В регуляции образования нитрогеназы важная роль принадлежит ферменту глутаминсинтетазе. Глутаминсинтетаза и глутаматсинтаза необходимы микроорганизмам, чтобы включать ионы аммония в органические соединения в тех случаях, когда их концентрация NH4 низка. Благодаря высокому сродству к ионам аммония эти ферменты поддерживают концентрацию NHJ в бактериальной клетке на низком уровне. Увеличение концентрации ионов аммония в среде, а следовательно, и внутри клетки бактерии, ингибирует глутаминсинтетазу, а в конечном итоге и синтез нитрогеназы.
Бактериальные гены, вовлеченные в процесс азотфиксации, обозначаются индексами nif и fix. Синтез нитрогеназного комплекса у микроорганизмов непосредственно кодируется 17 nif-генами, которые либо входят в состав хромосомы (Klebsiella, Bradyrhizobium), либо существуют в форме огромной мегаплазмиды (Rhizobium). Остальные гены, участвующие в азотфиксации (кроме л//-генов), относят к /be-генам. Гены nif высококонсервативны, поэтому при переносе в другие виды бактерий продукты указанных генов легко «вписываются» в метаболизм нового хозяина. Следовательно, способность к связыванию азота может передаваться от одной бактерии к другой при прямом межклеточном контакте. Благодаря существованию эффективных систем обмена генетической информацией nif- гены достаточно широко распространены в мире микроорганизмов.
В 80-х гг. XX столетия разрабатывался генно-инженерный проект, направленный на перенос ////-генов в высшие растения с тем, чтобы обеспечивать фиксацию азота непосредственно в растительных тканях независимо от наличия симбиотических микроорганизмов. В рамках этого проекта была предпринята попытка передать группу ////-генов Klebsiella pneumoniae в клетки низших эукариот — дрожжей. В одном случае все 17 ////-генов были интегрированы в хромосому дрожжей, а в другом — была осуществлена трансформация дрожжевых клеток автономной плазмидой со встроенной ////-областью.
Однако в обоих типах трансформированных клеток дрожжей — и с хромосомой, и с плазмидной локализацией nif-области — отсутствовала как фиксация азота, так и заметная экспрессия каких бы то ни было трансформированных генов. Осуществление азотфиксации вне клеток азотфиксирующих бактерий сопряжено с большими трудностями, в частности, поскольку для связывания N2, помимо нитрогеназы необходимы еще специфичные железои серосодержащие белки, требуется также защита этого фермента от кислорода. Однако удалось передать ////-гены от Klebsiella pneumoniae к Escherichia coli при конъюгации, при этом наблюдались нормальная экспрессия ////-генов и успешная азотфиксация. Успешно проведены и другие эксперименты по переносу плазмидных ////-генов в клетки неазотфиксируюших прокариот.
Контрольные вопросы и задания
1. Каково значение фиксации молекулярного азота для растений? 2. Приведите примеры свободноживущих микроорганизмов, усваивающих азот. 3. В чем суть ассоциативной азотфиксации и какие микроорганизмы се выполняют? 4. Какие растения вступают в симбиотические отношения с азотфиксирующими бактериями? 5. Перечислите симбиотические признаки клубеньковых бактерий. 6. На какие стадии можно разделить процесс восстановления молекулярного азота до аммиака?