Химические средства защиты растений (пестициды)

Как указывалось, природная генетическая селекция может обеспечить способность микроорганизма к разложению специфического вещества. Однако подобные методики нуждаются в длительном периоде селекции (8—10 мес.) и основываются на случайном наборе генетического материала для получения желаемой катаболитной системы. Использование же методов рекомбинантной ДНК дает экспериментатору возможность соединять… Читать ещё >
Химические средства защиты растений (пестициды) (реферат, курсовая, диплом, контрольная)
Химические средства защиты урожая — пестициды — используются в сельском хозяйстве очень широко. В них входят гербициды, применяемые для борьбы с сорняками, фунгициды, защищающие растения от фитопатогенных грибов, инсектициды — средства защиты от вредных насекомых, нематициды — препараты против нематод и пр.
Широкое применение химических средств защиты урожая началось после 1939 г., когда швейцарский ученый П. Мюллер показал перспективность использования ДДТ 11,1-ди (4-хлорфснил)-2,2,2- трихлорэтана] при борьбе с вредными насекомыми. Открывались новые перспективы в борьбе с вредителями сельского хозяйства и с насекомыми — переносчиками болезней. Применение ДДТ в южных странах практически ликвидировало заболевание малярией, от которой гибли миллионы людей. Однако через некоторое время оказалось, что комары, переносящие заболевание, адаптировались к пестициду, и болезнь вновь приняла массовый характер. Тогда перешли на использование менее токсичного аналога ДДТ — метоксихлора (С,6Н|5С1302).
В дальнейшем выяснилось, что ДДТ очень медленно разлагается в почве. Накапливаясь в почве и растениях, он оказывает вредное влияние на организм человека и животных. Помимо высокой стойкости, для ДДТ и ряда других пестицидов характерна способность концентрироваться в биологических цепях. В продуктах животного происхождения они накапливаются больше, чем в растительных тканях. Получены убедительные доказательства отрицательного воздействия даже малых количеств хлорорганических соединений на здоровье людей, и многие страны отказались от применения таких препаратов. В нашей стране проводят гигиеническую оценку новых пестицидов. Ежегодно публикуется также Список химических и биологических средств борьбы с вредителями, болезнями растений, сорняками и регуляторов роста растений, разрешенных для применения в сельском хозяйстве.
Неумеренное применение пестицидов загрязняет окружающую среду и приводит к гибели многих ценных представителей фауны и флоры. Попадая в водные бассейны, пестициды вызывают вымирание промысловых животных. Поэтому к применению пестицидов нужно относиться крайне осторожно и отбирать для практического использования в сельском хозяйстве наименее вредные и быстро разлагающиеся соединения.
Химическая природа пестицидов весьма разнообразна — они относятся более чем к 20 различным группам соединений. Наиболее широко используют феноксипроизводные, производные карбаминовой и тиокарбаминовой кислот, триазина, мочевины, урацила, аминов и т. д. Как инсектициды в больших количествах применяют фосфорорганические соединения, меньше — хлорорганические и производные карбаминовой кислоты. Находят применение и вещества, содержащие мышьяк и растительные яды, используют также соединения меди, ртути и т. д.
шят Трансформация пестицидов в почве. Рассматривая трансформацию пестицидов в почве, следует отметить, что на нее влияют химические и физические факторы, сорбция почвенными частицами и т. д. Однако главный фактор, вызывающий изменение пестицидов в почве, — микроорганизмы. Их жизнедеятельность заметно не угнетается дозами пестицидов, обычно используемыми в практике.
К химическим процессам, вызывающим превращения пестицидов, относится реакция гидролиза, которая часто катализуется глинистыми минералами. Быстрота микробиологического разрушения пестицидов в значительной степени зависит от их химического состава. Если в структуре пестицида присутствуют галогенные, нитроили метальные группы, то замедляется процесс микробной деструкции. Важное значение имеет также положение галогена в феноксисоединениях. Наличие галогена в мета-положении замедляет распад пестицида; соединения, имеющие галоген в параи орто-положении, разрушаются легче.
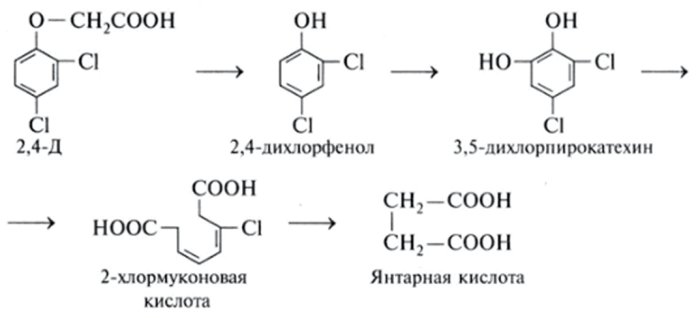
Наиболее быстро разлагаются органические соединения фосфора, производные алифатических карбоновых кислот, карбаминовой и тиокарбаминовой кислот. Значительно медленнее подвергаются разрушению циклические соединения. Примером разрыва бензольного кольца может быть процесс деградации в последнее время запрещенного к применению гербицида 2,4-Д:
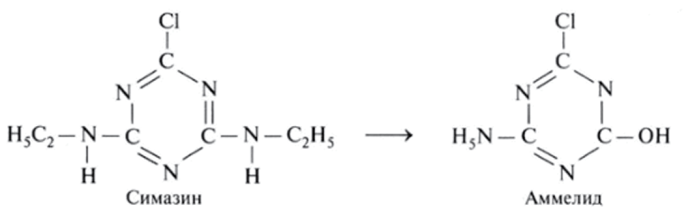
Гербицид симазин при отщеплении боковых группировок С2Н5 превращается в аммелид, кольцо которого в дальнейшем разрывается:
Некоторые пестициды могут разлагаться лишь определенными видами микроорганизмов. Так, к микроорганизмам, использующим аллиловый спирт, относятся Nocardia coralline, Azotobacter, Trichoderma vulgaris и т. д.
Некоторые виды рола Nocardia способны ассимилировать в качестве источника углерода 4-феноксимасляную и 3,5-дихлорфеноксимасляную кислоты. Симазин может служить источником питания для ряда микроорганизмов. Так, к использованию симазина способны многие виды бактерий, например представители родов Achromobacter, Mycobacterium и т. д.
Пестициды и другие соединения неприродного происхождения (ксенобиотики), которые подвергаются полной минерализации (деградации) до С02 и Н20, NH3, сульфатов и фосфатов, обычно проходят весь метаболический путь и могут использоваться в качестве источника углерода и энергии членами микробного сообщества.
Трансформация соединений, разлагаемых в большей или меньшей степени, происходит обычно в результате кометаболизма. Иначе говоря, эти соединения не являются субстратом для роста микроорганизмов, но пока используются другие субстраты, организмы могут трансформировать их, хотя и медленно.
К соединениям, не поддающимся трансформации микроорганизмами, относятся синтетические полимеры и некоторые ароматические углеводороды. Каждый тип окружающей среды (почвы, водоемы и др.) обладает своей популяцией микроорганизмов. Даже в самых экстремальных условиях, при высокой температуре и низком pH, существуют определенные микроорганизмы. Однако именно благодаря разнообразию микробных сообществ, существующих в разнообразных, в том числе в экстремальных, условиях, а также вследствие гетерогенности природных популяций многие устойчивые ксенобиотики могут подвергнуться деградации.
Отдельный вид микроорганизмов может обладать катаболитной способностью катализировать трансформацию одного соединения в другое, но не иметь ферментативной системы для дальнейшей деградации. Это может быть восполнено вторым (и так далее) микроорганизмом с комплементарным катаболическим свойством, и тогда соединение будет полностью разложено. Синергическая деградация ксенобиотиков может также предотвратить появление токсичных интермедиатов, поскольку в ряде случаев частичное разложение приводит к возникновению более токсичных соединений, чем исходное вещество.
Благодаря существующим в микробных сообществах природным путям разрушения токсинов становится возможным использовать микроорганизмы для борьбы с загрязнением окружающей среды, особенно органическими соединениями. Далее будут рассмотрены различные способы, которыми можно воздействовать на микроорганизмы или их сообщества, чтобы катализировать необходимые реакции, а также возможности генно-инженерных методов, позволяющих расширить круг применения таких биокатализаторов.
Огромный потенциал природных микробных сообществ в отношении деградации новых соединений стал очевиден уже в первых исследованиях по биодеградации. Так, было обнаружено, что при повторном попадании нового соединения в окружающую среду индукционный период, предшествующий биодеградации, уменьшается по сравнению с индукционным периодом при первом попадании. В течение времени, предшествующего деградации, популяция микроорганизмов адаптируется к данному соединению или в ней происходит отбор к его деградации. Это приводит к распространению популяции, которая может разлагать внесенное вещество, а затем достаточно долго (по меньшей мерс три месяца) сохраняться после его исчерпания. Поэтому к моменту поступления следующих порций этого соединения микроорганизмы, способные к его деградации, уже присутствуют в популяции, следовательно, деградация начинается много раньше.
Добавление нового субстрата в окружающую среду может запускать механизм отбора, т. е. имеет место природное генетическое конструирование. В ответ на присутствие нового субстрата микроорганизмы, изначально нс обладавшие способностью эффективно использовать данное соединение, «реконструируются» путем переноса генетической информации, что приводит к появлению необходимых каталитических функций и способности утилизировать новое соединение. Согласно исследованиям, проведенным на кафедре микробиологии МСХА, фунгицид амистар (дезоксистробин) интенсивно разлагается начиная с 60-го дня после его внесения в почву. Повидимому, только через 2 месяца в почве появились генетически «реконструированные» микроорганизмы, обладающие катаболической функцией деградировать фунгицид. Интересно отметить, что разлагающие амистар микроорганизмы, выделенные из почвы с этим фунгицидом, относились к родам Nocardia, Arthrobacter и Mycobacterium. Эти бактерии использовали его в качестве единственного источника углерода и энергии. Вероятно, в генетическом потоке между микроорганизмами происходит случайный обмен генетическим материалом. Однако как только происходит удачная перестановка, «новый» микроорганизм получает селективное преимущество. Эго позволяет предполагать, что наблюдаемые в лаборатории обмены генетическим материалом между микроорганизмами, даже через межвидовые и межродовые барьеры, встречаются и в естественных условиях.
С тех пор как были опубликованы доказательства трансмиссибельности устойчивости к лекарственным препаратам среди энтеробактерий, стала очевидной возможность внсхромосомных генетических элементов, или плазмид, в переносе генетической информации от одного микроорганизма к другому. Термин «катаболитическая плазмида» (деградативная, или метаболическая, плазмида) относится к тем ре пли конам, которые кодируют одну реакцию или многоэтапную последовательность реакций, приводящую к трансформации или минерализации субстрата. Присутствие катаболических плазмид в бактериальных сообществах придает микроорганизмам способность перераспределять между собой пул деградативных генов. Таким образом, плазмиды увеличивают биохимическую изменчивость популяции.
Генетическая информация, которую несут катаболичсские плазмиды, сможет расширить круг субстратов микроорганизма либо полным кодированием нового биохимического пути, либо дополнением и продолжением уже существующих путей, кодируемых генами хромосомы, либо объединением двух метаболических путей. Комплементация, таким образом, особенно важна, если существующие механизмы приводят только к частичной деградации соединения, в результате которой накапливаются потенциально токсичные метаболиты. Такие плазмиды могут также обеспечивать существование ферментов, катализирующих с большей субстратной специфичностью реакции ферментных систем, закодированных в хромосомах. Из почвенных бактерий были выделены плазмиды с молекулярной массой от 1,5 до более чем 900 тыс. п. н. (пар нуклеотидов). Плазмиды, используемые для конструирования векторов, обычно малы (2—10 000 п. н.), в то время как катаболические плазмиды относятся к наиболее крупным.
Хотя катаболические плазмиды были выделены из разнообразных бактерий, наиболее часто они идентифицируются у бактерий рода Pseudomonas. Значительная изменчивость катаболических плазмид в этом роде объясняет широкие катаболитичсскис возможности, которыми обладают его представители. Физический размер этих плазмид позволяет им кодировать большое количество генов. Плазмида длиной 150 тыс. п. н. содержит ДНК в количестве, достаточном для кодирования приблизительно 150 генов.
Макроэволюционные события (воздействие факторов среды) приводят к инсерциям, дслециям или перераспределению последовательности ДНК в плазмидах. Такие рекомбинационные события изменяют структурную целостность плазмиды и тем самым могут влиять на экспрессию ее генов путем их переориентации относительно промотора или удаления инерционно инактивированнных последовательностей. Рекомбинация между двумя фенотипически разными плазмидами может привести к сосуществованию обеих в интегрированном виде в одном организме. Этот процесс может преодолеть природный механизм исключения или несовместимости, которые обычно препятствуют сосуществованию в одном микроорганизме плазмид, принадлежащих к одной группе несовместимости. Таким образом, рекомбинационные события увеличивают метаболические возможности микроорганизма.
В настоящее время вполне определенно доказано, что имеет место перетекание генетического материала в плазм ид ные геномы и обратно. Молекулярная природа плазмидной эволюции может служить объяснением разнообразия катаболитических фенотипов, связанных с одной группой плазмид. Известно, однако, что эти плазмиды обладают изменчивой структурой и существуют в стабильной форме только тогда, когда условия среды подавляют перенос генетического материала. Когда катаболическая функция связана с определенной плазмидой, дальнейшие структурные изменения плазмиды подавляются давлением отбора, в данном случае постоянным поступлением субстрата.
Пластичность катаболических плазмид обеспечивает механизм, с помощью которого обмен генетическим материалом может привести к «созданию» организма, способного к эффективной утилизации нового субстрата в фазе обогащения (т. е. в накопительной культуре), как это описано для микроорганизмов, использующих галогензамещенныс жирные кислоты. В этих исследованиях шесть изолированных штаммов микроорганизмов, способных расти на хлоруксусной кислоте или пропионовой кислоте, обладали одной из плазмид размером от 150 до 290 тыс. п. н. Потеря плазмиды тремя из этих штаммов сопровождалась потерей способности к дегалогенированию, а также к росту на этом субстрате.
Из окружающей среды выделены микроорганизмы, способные разлагать ряд ксенобиотиков. Описаны генетические механизмы, которые способствуют перегруппировке координированно функционирующих генов и тем самым получению новых комбинаций катаболических функций, приспособленных к деградации молекул ксенобиотиков.
Общепринятые методы работы с рекомбинантной ДНК позволяют переносить генетическую информацию от одного микроорганизма к другому. Однако клонированная чужеродная ДНК содержит небольшое число генов, часто только один структурный ген, кодирующий белок, который катализирует определенную реакцию.
Учитывая генетические методы получения штаммов микроорганизмов, способных к детоксикации окружающей среды, значение общепринятых методов конструирования рекомбинантной ДНК ограничено. С этой целью более широко используется конструирование необходимых микроорганизмов при помощи природных генетических механизмов обмена. Очевидно, однако, что конструирование рекомбинантной ДНК может быть использовано для усовершенствования этих деградативных способностей.
Как указывалось, природная генетическая селекция может обеспечить способность микроорганизма к разложению специфического вещества. Однако подобные методики нуждаются в длительном периоде селекции (8—10 мес.) и основываются на случайном наборе генетического материала для получения желаемой катаболитной системы. Использование же методов рекомбинантной ДНК дает экспериментатору возможность соединять вместе определенные катаболические последовательности и контролировать экспрессию специфических генов. Применение методов клонирования для манипуляции подобными генами нс может рассматриваться как панацея, обеспечивающая при всех обстоятельствах получение микроорганизмов для борьбы с любыми загрязнениями. Имеется ряд ограничений для использования методологии клонирования для получения «суперштамма»: I) многоэтапное^ путей деградации; 2) ограниченные знания об индивидуальных катаболических путях; 3) опасность попадания сконструированных микроорганизмов в окружающую среду. Первое из перечисленных ограничений — сложная структура ксенобиотиков — требует многоэтапных путей для достижения полной их минерализации. Клонирование одного или двух генов в микроорганизме дает ему возможность разлагать вещество только в том случае, если новые генные продукты дополняют существующие катаболические системы. Лишь в этом случае клонирование расширит метаболические возможности микроорганизма. Применение этих методов, следовательно, позволит более направленно конструировать микроорганизмы. Однако следует подчеркнуть, что даже новейшая методология может использоваться только для получения микроорганизмов, способных расти на одном или двух субстратах. Часто эта способность зависит также от вредных мутационных событий, происходящих вследствие манипуляций in vitro, так как нашего понимания генетических механизмов еще недостаточно для направленного получения желаемых генетических форм. Это отражает недостаток генетических знаний об этих микроорганизмах, столь важных для процессов биологической очистки. Пока хорошо разработаны методы клонирования генов для.
Е. coli и некоторых видов Bacillus и Streptomyces, а клонирование генов для Pseudomonas в настоящее время в основном состоит из манипуляций с катаболичсскими плазмидами или их частями.
Отсутствие знаний о метаболических путях также ограничивает применение методов рекомбинантной ДНК для ускорения прогресса в этой области. Без таких знаний невозможно идентифицировать гены, которые наиболее выгодно клонировать, особенно те, которые лимитируют набор субстратов или скорость их использования.
Предпосылкой использования методов рекомбинантной ДНК является существование векторных систем для предполагаемого микроорганизма-хозяина. Для ряда микроорганизмов, используемых для борьбы с загрязнениями, не существует хорошо охарактеризованных векторов. Один из возможных способов разрешения этой проблемы — это использование векторов с широким кругом хозяев, например вектора-плазмиды R 300 В. Круг хозяев этой плазмиды включает Е. coli, Pseudomonas aeruginosa и виды родов Alcaligenes, Methylotropus, Salmonella, Serratia, Klebsiella, Proteus, Rhizobium и др. Использование таких плазмид, однако, находится на ранней стадии, и одна из основных проблем этих систем — стабильность.
Стабильность системы микроорганизм — вектор особенно важна, если организм планируют вносить в окружающую среду.
Возможность использования сконструированных микроорганизмов для борьбы с загрязнениями окружающей среды еще недостаточно проверена вне лаборатории. Предложения по манипулированию природными изолятами с последующим возвращением их в окружающую среду важны, но не всегда осуществимы. Простое перемещение микроорганизма из окружающей среды и культивирование его в лаборатории, часто на относительно обогащенной питательной среде, проявится в селекции мутаций, которые приспосабливают микроорганизм к новым условиям. Возвращение микроорганизмов в исходную среду снабженным новой катаболичсской функцией, которая даст ему возможность использовать субстрат, недоступный остальному микробному сообществу, теоретически дает этому организму селективное преимущество. Однако окружающая среда будет содержать и другие источники углерода; свалки токсических отходов обычно содержат много химических веществ, включая и более легкоусвояемые. В таких условиях сконструированные микроорганизмы должны обладать высокой стабильностью, чтобы обеспечить более эффективное использование целевого вещества. Мало или ничего нс известно о стабильности рекомбинантных штаммов в природной среде. Кроме того, исходная природная популяция, хорошо адаптированная к окружающей среде, подобна, но своей конкурентноспособности генетически усовершенствованному штамму. Применение методов рекомбинантной ДНК для получения биологических агентов для борьбы с загрязнениями пока еще только начинается.
Не меньшее значение имеют биотехнологические методы и для борьбы с загрязнением окружающей среды нефтью и нефтепродуктами. В настоящее время в связи со значительной интенсификацией добычи нефти и производства нефтепродуктов большие масштабы приобретает процесс отторжения земель из сельскохозяйственного использования. Согласно имеющимся данным, в настоящее время в России нуждается в рекультивации 1,2 млн га земель, пострадавших от различных типов загрязнений, включая и нефтяные. Нефть и нефтепродукты в эпоху научно-технического прогресса оказывают непрерывно возрастающее влияние на биосферу, они признаны приоритетными загрязнителями окружающей среды. Естественное самоочищение почв, вод и других природных объектов от нефтяного загрязнения является длительным процессом, продолжающимся от одного до нескольких десятилетий, в зависимости от природных условий региона, где произошел аварийный разлив нефти и осуществляется путем сложных процессов в биоценозах, содержащих ассоциации микроорганизмов, простейших и червей.
В процессах превращения углеводородов нефти в природе важную роль играют многие группы микроорганизмов, обладающих способностью использовать эти вещества в качестве единственного источника питания. Интенсивно разрабатываются методы рекультивации нефтезагрязненных почв, основанные на внедрении в естественные микробные ассоциации чистых или смешанных культур микроорганизмов-деструкторов в сочетании с приемами, повышающими их активность. С этой целью в последние годы рядом научно-исследовательских институтов и лабораторий осуществлялся поиск микроорганизмов-деструкторов нефти и проводилась разработка микробных биопрепаратов для очистки нефтезагрязненных почвы и воды. В настоящее время проходят испытания ряд микробных биопрепаратов, предназначенных для деструкции углеводородов нефти на нефтезагрязненных почвах: деворойл 1, деворойл 2, деворойл (паста), инипол, фаерзайм, биоприн, деградойлас 81, ремедиаст, биопрепарат 670, нафтокс, нафтокс (жидкий), псевдомин и др. Последний препарат был разработан на кафедре микробиологии МСХА. Он обладает способностью к деградации растворенных и высокоэмульгированных нефтепродуктов, освобождение от которых можно считать пределом возможности механических способов очистки. За два месяца содержание нефти в почВс снижается на 98%. Кроме того, бактерии рода Pseudomonas, на основе которых был создан препарат, хорошо приживаются в почве, загрязненной нефтепродуктами, размножаются и доминируют в биоценозе углеводородокисляющих микроорганизмов. Это указывает на возможность их пролонгированного деградационного последействия на нефтепродукты, остающиеся, хотя и в небольших количествах, в почве. Испытание «Псевдомина» в сравнении с названными выше биопрепаратами показало, что он является весьма перспективным деструктором нефтепродуктов в почве, значительно ускоряя разложение загрязнителя. Поэтому биопрепарат «Псевдомин» может быть рекомендован для крупномасштабного промышленного производства в целях его широкого применения для очистки почв, загрязненных нефтепродуктами.
Следовательно, в интенсификации биодеградации нефти и нефтепродуктов микробные биопрепараты, созданные на основе углеводородокисляющих микроорганизмов, должны играть все возрастающую роль. Это объясняется в первую очередь тем, что микроорганизмы, используемые в подобных биопрепаратах, обладают значительно большей активностью, чем природные формы, благодаря природной генетической селекции. Направленное регулирование жизнедеятельности углеводородокисляющих микроорганизмов в природных субстратах с помощью соответствующих биопрепаратов, построенное на углубленном познании их биологии, призвано сыграть большую роль в решении ряда актуальных проблем современности, связанных с многочисленными случаями нефтяного загрязнения почв.
Влияние пестицидов на почвенные микроорганизмы и обеззараживание почвы. Гербициды вносят в почву в небольших количествах — несколько килограммов на 1 га. Водорастворимые препараты не создают в местах внесения токсичных для большинства микроорганизмов концентраций. При распылении порошков и эмульсий образуются микрозоны, в которых селекционируется микрофлора, разлагающая пестицид, но основное микронаселение почвы остается незатронутым. В то же время использование гербицидов несколько снижает количество гумуса по сравнению с необработанными почвами. Это объясняется тем, что гербициды уменьшают поступление в почву растительных остатков сорняков.
Обычно применяемые в практике дозировки пестицидов, как правило, не влияют на жизнь почвы. Однако иногда происходит задержка процесса нитрификации, так как нитрификаторы очень чувствительны к различного рода сильным воздействиям. Некоторые исследователи отмечают большую чувствительность по сравнению с другими сапротрофными микроорганизмами азотобактера и клубеньковых бактерий. Малоустойчивы к гербицидам микроскопические грибы и водоросли.
Отмеченная чувствительность к пестицидам относится в основном к повышенным их дозам. На основную же массу микроорганизмов дозы, даже в 50—100 раз превышающие применяемые на практике, не оказывают существенного влияния.
Несомненно, что не все микроорганизмы одинаково чувствительны к определенным препаратам. Каждое химическое соединение больше всего поражает какую-то свою «мишень». Разработка этого вопроса может способствовать выявлению микробиологических показателей наличия и детоксикации определенных гербицидов в почве.
Отмеченное можно проиллюстрировать примерами. Э. А. Штиной было установлено, что Phormidium tenue погибает при незначительных концентрациях 2,4-Д, а другие организмы (Chlorella vulgaris, Nostoc punctiforme и т. д.) весьма устойчивы к действию этого гербицида. Ю. В. Круглое показал, что чувствительность водоросли Chlorella vulgaris к некоторым гербицидам приближается к чувствительности растений овса. Очевидно, Chlorella может быть использована как тест-организм при выяснении токсичности гербицидов для растений.
Некоторые исследователи пытались определить суммарный эффект действия гербицидов на микрофлору почвы по изменению ее дыхания. В опытах, проводимых по методике Варбурга, тормозящее действие на «дыхание» почвы оказывали лишь дозы гербицидов, в десятки раз превосходящие используемые на практике. Однако, если энергию дыхания почвы определяют в течение длительного срока (за 28 и 56 дней), то даже небольшая доза симазина снижает выделение С02 почвой.
Возникает весьма важный вопрос: за какой срок обезвреживаются в почве применяемые обычно в практике дозы гербицидов. На это влияет целый ряд факторов — биологические и химические свойства почвы, ее температура, влажность и т. д. На быстроту распада гербицидов в почве большое влияние может оказывать присутствие легкодоступных микроорганизмам органических и минеральных соединений. Следовательно, без учета комплекса факторов трудно определить быстроту распада гербицида в почве. Известны случаи, когда в европейских странах ориентировались на американские данные по освобождению почв от симазина. Так, в результате недоучета особенностей климата резко снижался урожай пшеницы, высеянной после кукурузы, обработанной симазином.
Несмотря на условность сроков распада различных гербицидов, приведенные в таблице 17 данные свидетельствуют о стабильности в почве подобных соединений. Например, одни гербициды распадаются в почве через несколько недель, другие сохраняются больше года, существуют и еще более устойчивые вещества.
Таблица 17.
Примерные сроки разрушения в почве практически используемых1 дозировок гербицидов, мес.
До1. | 1−3. | 4−6. | 7−12. | Более 12. |
Пропанид Ялан | 2,4-Д Бетанал Далапон Пи рамин Ронит Эптам | Диурон Котора н Вснзар | Прометрин Трихлорацетат натрия | Атразин Симазин |
В связи с тем что скорость детоксикации пестицидов в почвах и окружающей среде (грунтовые воды, водные бассейны и т. д.) зависит от географических, почвенных, гидрологических и других условий, составлена карта, дающая представление о способности отдельных регионов самоочищаться от вносимых в почву токсических соединений.
Следует отметить, что при частичном разрушении гербицида могут образоваться сильнотоксичные вещества. Например, когда из атразина отщепляется группировка С2Н5, образуется хлораминоизопропиламинотриазин:
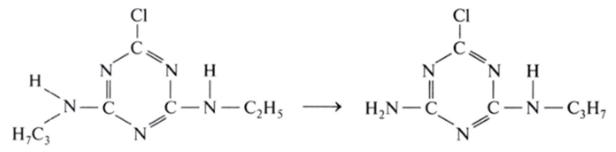
1 Большинство приведенных в таблице гербицидов в настоящее время запрещено для применения; таблица оставлена лишь как пример.
Иногда происходит конденсация веществ, образующихся из гербицидов, в трудноразлагаемые сложные соединения. Некоторые гербициды (симазин и др.), а также продукты их распада образуют с гумусовыми соединениями прочные комплексы. Это задерживает процесс их детоксикации.
В отношении инсектицидов имеются данные, свидетельствующие о довольно быстром распаде в почве фосфорорганических соединений (полтора—четыре месяца); хлорорганические соединения устойчивее.
Рассмотрим влияние пестицидов на взаимоотношения бобовых растений с клубеньковыми бактериями. Здесь наблюдаются значительные различия. Так, гербициды, ингибирующие фотосинтез (симазин, атразин), не действуют на образование клубеньков, но процесс азотфиксации подавляется ими вследствие недостатка ассимилятов для клубеньковых бактерий. Другие гербициды депрессируют активность находящихся в клубеньках бактерий и снижают азотфиксацию.
Таким образом, для бобовых культур следует особенно тщательно подбирать гербициды и желательно употреблять их в сниженных дозах. Предпочтительнее вообще использовать для этих культур почвы, очищенные от сорняков при выращивании предшественников.
Протравливать семена бобовых растений целесообразно не позднее чем за две недели до посева. Заражение же посевного материала клубеньковыми бактериями надо проводить в день посева.
Обработка почвы в защищенном грунте пестицидами в последнее время запрещена. Частично стерилизовать почву для парников и теплиц можно высокой температурой (пастеризация). В таких случаях горячий пар вводят в почву при помощи специальных приспособлений. Многие фитопаразиты погибают при температуре 55—60 °С, в связи с чем почву пастеризуют нагреванием до 70 °C в течение 1 ч. За это время погибают грибы родов Sclerotinia и Phytophtora. Другие патогенные организмы гибнут еще быстрее. Если температура прогрева ниже 70 °C, то время прогревания увеличивают.
Контрольные вопросы и задания
1. Как изменились взгляды ученых на воздействие обработки почвы на почвенное микронаселение со времен формирования теории обработки почвы В. Р. Вильямса? 2. Какое влияние оказывает внесение извести на отдельные группы микроорганизмов? 3. Расскажите о воздействии гипсования на микроорганизмы почвы. 4. Как сказывается превращение микроорганизмами в почве солей аммония в азотную кислоту на азотном питании растений? 5. Приведите схему использования азота минеральных удобрений посевами сельскохозяйственных культур. 6. Какие приемы позволяют снизить потери азота удобрений? 7. В каких доступных для растений формах присутствует в почве фосфор? 8. Какие процессы распада минералов, содержащих кадий, идут с участием микроорганизмов? 9. Чем определяется быстрота разрушения пестицидов в почве? 10. Как влияют пестициды на формирование микробных ценозов в почве? 11. Приведите примеры условий, в которых задерживается процесс деструкции гербицидов.