Теплоемкость газов и их смесей

Расчетные приближенные формулы для определения средних теплоемкостей при постоянном давлении для различных газов в интервале температур от 0 до 1000 °C приведены в специальных таблицах. Использование (1.31) и (1.32) позволяет обойтись при расчетах без справочных таблиц. Рис. 1.1. Зависимость теплоемкости от температуры Графически коэффициент, а выражает теплоемкость газа при 0 °C, а коэффициент Ь… Читать ещё >
Теплоемкость газов и их смесей (реферат, курсовая, диплом, контрольная)
Теплоемкостью © называют отношение количества теплоты, необходимой для изменения температуры в веществе на бесконечно малую величину:

Такую теплоемкость называют истинной.
При решении практических задач используют среднюю теплоемкость — условную постоянную величину в определенном интервале температур:

В зависимости от единиц количества вещества различают:
- • массовую теплоемкость с, кДж/(кг • К);
- • молярную теплоемкость рс или См, кДжДкмоль-К);
• объемную теплоемкость С или с', отнесенную к 1 м3 газа при нормальных физических условиях (j) = 760 мм рт. ст., t = 0°С), кДж/(м3 • К) .
Массовая, молярная и объемная теплоемкости связаны между собой следующими зависимостями:

где |i — молекулярная масса вещества, кг/кмоль; vH, рн — удельный объем и плотность вещества при нормальных условиях; 22,4 м3/кмоль — объем одного киломоля любого идеального газа при нормальных физических условиях[1].
Теплоемкость рабочего тела зависит от характера процесса, поэтому тоже является функцией процесса. В различных процессах теплоемкость может принимать значения в пределах -(c)о < С <+.
При анализе термодинамических процессов, протекающих при постоянном объеме (изохорных), используют изохорную теплоемкость cv, icv, c'v, при анализе термодинамических процессов, протекающих при постоянном давлении (изобарных), используют изобарную теплоемкость ср, хср, с'р.
Используя выражения первого начала термодинамики, запишем:
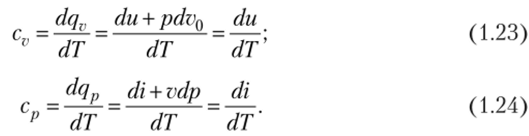
Поскольку внутренняя энергия и энтальпия идеального газа зависят только от температуры, то их изменения в любом процессе можно рассчитать по формулам:
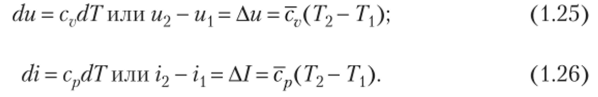
Связь между изобарной и изохорной теплоемкостями можно установить следующим образом. В изобарном процессе подведенная qp теплота расходуется на изменение внутренней энергии и на совершение внешней работы, а в изохорном — теплота qv расходуется только на изменение внутренней энергии. При нагревании 1 кг рабочего тела на одинаковую температуру разность между теплотой qp и qv будет равна работе, произведенной в процессе при р = const, т. е.
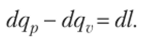
Для идеального газа работа в изобарном процессе может быть определена из уравнения состояния после дифференцирования последнего:

После подстановки значений (к]р и с1дг, и сокращения на с1Т получаем.

Формула (1.27), устанавливающая связь между изобарной и изохорной теплоемкостями, называется уравнением Майера. Из нее вытекает также физический смысл газовой постоянной: газовая постоянная Я равна работе 1 кг газа в изобарном процессе при изменении его температуры на один кельвин (1 К). Разные газы в изобарном процессе производят неодинаковую работу.
Умножая обе части равенства (1.27) на молекулярную массу, получаем.
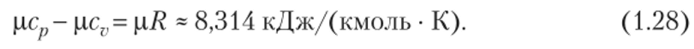
Величина хЯ (или /?м) называется универсальной газовой постоянной. Из (1.28) следует, что разность молярных изобарной и изохорной теплоемкостей для идеальных газов является величиной постоянной.
При решении теплотехнических задач необходимо знать значения теплоемкостей различных газов. При невысоких температурах можно пользоваться значениями теплоемкостей, полученными на основе классической молекулярно-кинетической теории газов, согласно которой теплоемкость идеального газа зависит только от количества атомов в молекуле газа, характера процесса и не зависит от температуры.
Мольные теплоемкости идеальных газов в процессе, протекающем при постоянном объеме, имеют следующие значения: рсГ = 12,6 кДжДкмоль • К) — одноатомные газы; рс?1= 20,9 кДжДкмоль • К) — двухатомные газы; цс1)= 29 кДжДкмоль • К) — трехи многоатомные газы.
Мольная изобарная теплоемкость может быть рассчитана, но формуле (1.28). Массовые и объемные теплоемкости идеальных газов определяют по (1.21) и (1.22).
Сравнивая приведенные значения теплоемкости с опытными данными, можно прийти к следующим выводам. Если для одноатомных газов приведенные значения теплоемкостей хорошо совпадают с опытными результатами, то для двухатомных газов такое совпадение наблюдается только при температурах 0—20°С. При более высоких температурах имеют место значительные расхождения в величинах теплоемкостей.
Для трехи многоатомных газов значения теплоемкости, полученные на основании молекулярно-кинетической теории газов, даже при невысоких температурах резко отличаются от величин теплоемкости, определяемой опытным путем. Эти расхождения объясняются тем, что классическая молекулярно-кинетическая теория газов не учитывает внутреннюю энергию колебательного движения атомов внутри молекулы. Влияние ее на величину теплоемкости тем сильнее, чем больше число атомов в молекуле и выше температура. Так, например, теплоемкость воздуха при 300 °C по сравнению с теплоемкостью при 0 °C увеличивается на 4%, а при 2000 °C — почти на 25%. Еще больше увеличивается теплоемкость с повышением температуры у трехатомных газов.
В тепловых двигателях происходит значительное изменение температуры газа, поэтому необходимо учитывать зависимость теплоемкости от температуры: 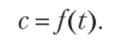
Эту зависимость находят экспериментальным путем, она имеет вид алгебраического многочлена: 
где а, /?, сI — коэффициенты, определяемые опытным путем.
Как следует из (1.29) и рис. 1.1, в общем случае теплоемкость имеет криволинейную зависимость от температуры. Величины истинных и средних изохорных и изобарных теплоемкостей в зависимости от температуры приводятся в справочных таблицах. В них средние значения теплоемкостей дают для интервала температур от 0 до ?°С. Средние теплоемкости в интервале температур и ?2 с использованием таблиц вычисляют по формуле.
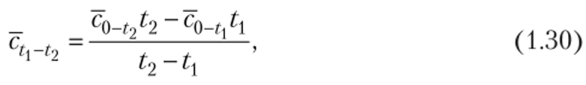
где с0_Г1, с0_Г2 — средние табличные теплоемкости газа в интервале температур (0—и (0—?2), °С.
В (1.30) числитель представляет собой количество теплоты, подводимой к газу с целью повышения его температуры от до ?2> °С.
Часто в теплотехнических расчетах криволинейную зависимость теплоемкости от температуры заменяют близкой к ней прямолинейной зависимостью (рис. 1.1). В этом случае истинную теплоемкость определяют, но следующей приближенной формуле:

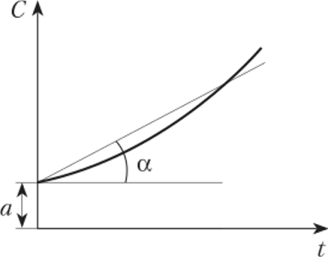
Рис. 1.1. Зависимость теплоемкости от температуры Графически коэффициент а выражает теплоемкость газа при 0 °C, а коэффициент Ь является тангенсом угла, а наклона прямой. В таком случае среднюю теплоемкость газа в интервале температур от Ьх до ?2 находят по формуле.
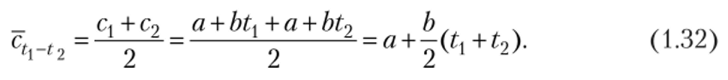
Расчетные приближенные формулы для определения средних теплоемкостей при постоянном давлении для различных газов в интервале температур от 0 до 1000 °C приведены в специальных таблицах. Использование (1.31) и (1.32) позволяет обойтись при расчетах без справочных таблиц.
На теплоемкость реальных газов влияет не только температура, но и давление.
Для определения теплоемкости смеси газов необходимо знать ее состав и значения теплоемкостей компонентов.
При нагреве смеси на 1 °C каждый компонент также нагревается на 1 °C. Следовательно, если смесь задана массовыми долями, то теплоемкость смеси, кДж/К, 
где Мш — масса смеси, кг; ссм — массовая теплоемкость смеси, кДж/(кг • К); М1? М2,Мп — массы компонентов, кг; сх, с2, сп — массовые теплоемкости компонентов, кДж/(кг • К).
Разделив обе части последнего уравнения на Мсм, получим.
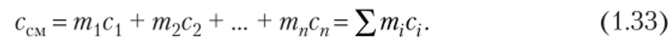
Если смесь задана объемными долями, то объемную теплоемкость 1 м3 смеси газов при нормальных физических условиях находят по формуле.
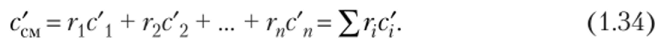
Мольную теплоемкость газовой смеси определяют, но аналогичной формуле:

- [1] В действительности объем одного киломоля газа при нормальных физических условиях отличается от 22,4 м3/кмоль. Данное значение приблизительно соответствует объемуодного киломоля двухатомных газов.